Обмен веществ — важнейшее свойство живых организмов. Совокупность реакций обмена веществ, протекающих в организме, называется метаболизмом . Метаболизм состоит из реакций ассимиляции (пластического обмена, анаболизма) и реакций диссимиляции (энергетического обмена, катаболизма). Ассимиляция — совокупность реакций биосинтеза, протекающих в клетке, диссимиляция — совокупность реакций распада и окисления высокомолекулярных веществ, идущих с выделением энергии. Эти группы реакций взаимосвязаны: реакции биосинтеза невозможны без энергии, которая выделяется в реакциях энергетического обмена, реакции диссимиляции не идут без ферментов, образующихся в реакциях пластического обмена.
По типу обмена веществ организмы подразделяются на две группы: автотрофы и гетеротрофы. Автотрофы — организмы, способные синтезировать органические вещества из неорганических и использующие для этого синтеза или солнечную энергию, или энергию, выделяющуюся при окислении неорганических веществ. Гетеротрофы — организмы, использующие для своей жизнедеятельности органические вещества, синтезированные другими организмами. В качестве источника углерода автотрофы используют неорганические вещества (СО 2), а гетеротрофы — экзогенные органические. Источники энергии: у автотрофов — энергия солнечного света (фотоавтотрофы ) или энергия, выделяющаяся при окислении неорганических соединений (хемоавтотрофы ), у гетеротрофов — энергия окисления органических веществ (хемогетеротрофы ).
Большинство живых организмов относится или к фотоавтотрофам (растения), или к хемогетеротрофам (грибы, животные). Если организмы, в зависимости от условий, ведут себя как авто- либо как гетеротрофы, то их называют миксотрофами (эвглена зеленая).
Биосинтез белков
Биосинтез белков является важнейшим процессом анаболизма. Все признаки, свойства и функции клеток и организмов определяются в конечном итоге белками. Белки недолговечны, время их существования ограничено. В каждой клетке постоянно синтезируются тысячи различных белковых молекул. В начале 50-х гг. ХХ в. Ф. Крик сформулировал центральную догму молекулярной биологии: ДНК → РНК → белок. Согласно этой догме способность клетки синтезировать определенные белки закреплена наследственно, информация о последовательности аминокислот в белковой молекуле закодирована в виде последовательности нуклеотидов ДНК. Участок ДНК, несущий информацию о первичной структуре конкретного белка, называется геном . Гены не только хранят информацию о последовательности аминокислот в полипептидной цепочке, но и кодируют некоторые виды РНК: рРНК, входящие в состав рибосом, и тРНК, отвечающие за транспорт аминокислот. В процессе биосинтеза белка выделяют два основных этапа: транскрипция — синтез РНК на матрице ДНК (гена) — и трансляция — синтез полипептидной цепи.
Генетический код и его свойства
Генетический код — система записи информации о последовательности аминокислот в полипептиде последовательностью нуклеотидов ДНК или РНК. В настоящее время эта система записи считается расшифрованной.
Свойства генетического кода:
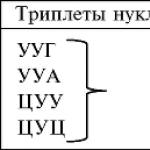
- триплетность: каждая аминокислота кодируется сочетанием из трех нуклеотидов (триплетом, кодоном);
- однозначность (специфичность): триплет соответствует только одной аминокислоте;
- вырожденность (избыточность): аминокислоты могут кодироваться несколькими (до шести) кодонами;
- универсальность: система кодирования аминокислот одинакова у всех организмов Земли;
- неперекрываемость: последовательность нуклеотидов имеет рамку считывания по 3 нуклеотида, один и тот же нуклеотид не может быть в составе двух триплетов;
- из 64 кодовых триплетов 61 — кодирующие, кодируют аминокислоты, а 3 — бессмысленные (в РНК — УАА, УГА, УАГ), не кодируют аминокислоты. Они называются кодонами-терминаторами , поскольку блокируют синтез полипептида во время трансляции. Кроме того, есть кодон-инициатор (в РНК — АУГ), с которого трансляция начинается.
Таблица генетического кода
| Первое основание | Второе основание | Третье основание |
|||
|---|---|---|---|---|---|
| У(А) | Ц(Г) | А(Т) | Г(Ц) | ||
| У(А) | Фен Фен Лей Лей |
Сер Сер Сер Сер |
Тир Тир — — |
Цис Цис — Три |
У(А) Ц(Г) А(Т) Г(Ц) |
| Ц(Г) | Лей Лей Лей Лей |
Про Про Про Про |
Гис Гис Глн Глн |
Арг Арг Арг Арг |
У(А) Ц(Г) А(Т) Г(Ц) |
| А(Т) | Иле Иле Иле Мет |
Тре Тре Тре Тре |
Асн Асн Лиз Лиз |
Сер Сер Арг Арг |
У(А) Ц(Г) А(Т) Г(Ц) |
| Г(Ц) | Вал Вал Вал Вал |
Ала Ала Ала Ала |
Асп Асп Глу Глу |
Гли Гли Гли Гли |
У(А) Ц(Г) А(Т) Г(Ц) |
* Первый нуклеотид в триплете — один из четырех левого вертикального ряда, второй — один из верхнего горизонтального ряда, третий — из правого вертикального.
Реакции матричного синтеза
Это особая категория химических реакций, происходящих в клетках живых организмов. Во время этих реакций происходит синтез полимерных молекул по плану, заложенному в структуре других полимерных молекул-матриц. На одной матрице может быть синтезировано неограниченное количество молекул-копий. К этой категории реакций относятся репликация, транскрипция, трансляция и обратная транскрипция.
Ген — участок молекулы ДНК, кодирующий первичную последовательность аминокислот в полипептиде или последовательность нуклеотидов в молекулах транспортных и рибосомных РНК. ДНК одной хромосомы может содержать несколько тысяч генов, которые располагаются в линейном порядке. Место гена в определенном участке хромосомы называется локусом . Особенностями строения гена эукариот являются: 1) наличие достаточно большого количества регуляторных блоков, 2) мозаичность (чередование кодирующих участков с некодирующими). Экзоны (Э) — участки гена, несущие информацию о строении полипептида. Интроны (И) — участки гена, не несущие информацию о строении полипептида. Число экзонов и интронов различных генов разное; экзоны чередуются с интронами, общая длина последних может превышать длину экзонов в два и более раз. Перед первым экзоном и после последнего экзона находятся нуклеотидные последовательности, называемые соответственно лидерной (ЛП) и трейлерной последовательностью (ТП). Лидерная и трейлерная последовательности, экзоны и интроны образуют единицу транскрипции. Промотор (П) — участок гена, к которому присоединяется фермент РНК-полимераза, представляет собой особое сочетание нуклеотидов. Перед единицей транскрипции, после нее, иногда в интронах находятся регуляторные элементы (РЭ), к которым относятся энхансеры и сайленсеры . Энхансеры ускоряют транскрипцию, сайленсеры тормозят ее.
Транскрипция — синтез РНК на матрице ДНК. Осуществляется ферментом РНК-полимеразой.
РНК-полимераза может присоединиться только к промотору, который находится на 3"-конце матричной цепи ДНК, и двигаться только от 3"- к 5"-концу этой матричной цепи ДНК. Синтез РНК происходит на одной из двух цепочек ДНК в соответствии с принципами комплементарности и антипараллельности. Строительным материалом и источником энергии для транскрипции являются рибонуклеозидтрифосфаты (АТФ, УТФ, ГТФ, ЦТФ).
В результате транскрипции образуется «незрелая» иРНК (про-иРНК), которая проходит стадию созревания или процессинга. Процессинг включает в себя: 1) КЭПирование 5"-конца, 2) полиаденилирование 3"-конца (присоединение нескольких десятков адениловых нуклеотидов), 3) сплайсинг (вырезание интронов и сшивание экзонов). В зрелой иРНК выделяют КЭП, транслируемую область (сшитые в одно целое экзоны), нетранслируемые области (НТО) и полиадениловый «хвост».
Транслируемая область начинается кодоном-инициатором, заканчивается кодонами-терминаторами. НТО содержат информацию, определяющую поведение РНК в клетке: срок «жизни», активность, локализацию.
Транскрипция и процессинг происходят в клеточном ядре. Зрелая иРНК приобретает определенную пространственную конформацию, окружается белками и в таком виде через ядерные поры транспортируется к рибосомам; иРНК эукариот, как правило, моноцистронны (кодируют только одну полипептидную цепь).
Трансляция
Трансляция — синтез полипептидной цепи на матрице иРНК.
Органоиды, обеспечивающие трансляцию, — рибосомы. У эукариот рибосомы находятся в некоторых органоидах — митохондриях и пластидах (70S-рибосомы), в свободном виде в цитоплазме (80S-рибосомы) и на мембранах эндоплазматической сети (80S-рибосомы). Таким образом, синтез белковых молекул может происходить в цитоплазме, на шероховатой эндоплазматической сети, в митохондриях и пластидах. В цитоплазме синтезируются белки для собственных нужд клетки; белки, синтезируемые на ЭПС, транспортируются по ее каналам в комплекс Гольджи и выводятся из клетки. В рибосоме выделяют малую и большую субъединицы. Малая субъединица рибосомы отвечает за генетические, декодирующие функции; большая — за биохимические, ферментативные.
В малой субъединице рибосомы расположен функциональный центр (ФЦР) с двумя участками — пептидильным (Р-участок) и аминоацильным (А-участок). В ФЦР может находиться шесть нуклеотидов иРНК, три — в пептидильном и три — в аминоацильном участках.
Для транспорта аминокислот к рибосомам используются транспортные РНК, тРНК (лекция №4). Длина тРНК от 75 до 95 нуклеотидных остатков. Они имеют третичную структуру, по форме напоминающую лист клевера. В тРНК различают антикодоновую петлю и акцепторный участок. В антикодоновой петле РНК имеется антикодон, комплементарный кодовому триплету определенной аминокислоты, а акцепторный участок на 3"-конце способен с помощью фермента аминоацил-тРНК-синтетазы присоединять именно эту аминокислоту (с затратой АТФ). Таким образом, у каждой аминокислоты есть свои тРНК и свои ферменты, присоединяющие аминокислоту к тРНК.
Двадцать видов аминокислот кодируются 61 кодоном, теоретически может быть 61 вид тРНК с соответствующими антикодонами. Но кодируемых аминокислот всего 20 видов, значит, у одной аминокислоты может быть несколько тРНК. Установлено существование нескольких тРНК, способных связываться с одним и тем же кодоном (последний нуклеотид в антикодоне тРНК не всегда важен), поэтому в клетке обнаружено всего около 40 различных тРНК.

Синтез белка начинается с того момента, когда к 5"-концу иРНК присоединяется малая субъединица рибосомы, в Р-участок которой заходит метиониновая тРНК (транспортирующая аминокислоту метионин). Следует отметить, что любая полипептидная цепь на N-конце сначала имеет метионин, который в дальнейшем чаще всего отщепляется. Синтез полипептида идет от N-конца к С-концу, то есть пептидная связь образуется между карбоксильной группой первой и аминогруппой второй аминокислот.
Затем происходит присоединение большой субъединицы рибосомы, и в А-участок поступает вторая тРНК, чей антикодон комплементарно спаривается с кодоном иРНК, находящимся в А-участке.
Пептидилтрансферазный центр большой субъединицы катализирует образование пептидной связи между метионином и второй аминокислотой. Отдельного фермента, катализирующего образование пептидных связей, не существует. Энергия для образования пептидной связи поставляется за счет гидролиза ГТФ.
Как только образовалась пептидная связь, метиониновая тРНК отсоединяется от метионина, а рибосома передвигается на следующий кодовый триплет иРНК, который оказывается в А-участке рибосомы, а метиониновая тРНК выталкивается в цитоплазму. На один цикл расходуется 2 молекулы ГТФ. В А-участок заходит третья тРНК, и образуется пептидная связь между второй и третьей аминокислотами.

Трансляция идет до тех пор, пока в А-участок не попадает кодон-терминатор (УАА, УАГ или УГА), с которым связывается особый белковый фактор освобождения. Полипептидная цепь отделяется от тРНК и покидает рибосому. Происходит диссоциация, разъединение субъединиц рибосомы.
Скорость передвижения рибосомы по иРНК — 5-6 триплетов в секунду, на синтез белковой молекулы, состоящей из сотен аминокислотных остатков, клетке требуется несколько минут. Первым белком, синтезированным искусственно, был инсулин, состоящий из 51 аминокислотного остатка. Потребовалось провести 5000 операций, в работе в течение трех лет принимали участие 10 человек.
В трансляции можно выделить три стадии: а) инициации (образование иницаторного комплекса), б) элонгации (непосредственно «конвейер», соединение аминокислот друг с другом), в) терминации (образование терминирующего комплекса).
«Механизмы» сборки полинуклеотидных и полипептидных цепочек у прокариот и эукариот не различаются. Но в связи с тем, что гены прокариот не имеют экзонов и интронов (исключение — гены архебактерий), располагаются группами, и на эту группу генов приходится один промотор, появляются следующие особенности транскрипции и трансляции у прокариот.
- В результате транскрипции образуется полицистронная иРНК, кодирующая несколько белков, совместно обеспечивающих определенную группу реакций.
- иРНК имеет несколько центров инициации трансляции, терминации трансляции и НТО.
- Не происходят КЭПирование, полиаденилирование и сплайсинг иРНК.
- Трансляция начинается еще до завершения транскрипции; эти процессы не разделены во времени и пространстве, как это имеет место у эукариот.

1 — ДНК; 2 — РНК-полимераза; 3 — Нуклеозидтрифосфаты ГТФ, ЦТФ, АТФ, УТФ.
Можно добавить, что срок «жизни» прокариотических иРНК — несколько минут (у эукариот — часы и даже сутки).
Перейти к лекции №9 « Строение прокариотической клетки. Вирусы»
Перейти к лекции №11 « Понятие об обмене веществ. Биосинтез белков»
Контуры клетки, даже на светооптическом уровне, не представляются ровными и гладкими, а электронная микроскопия позволила обнаружить и описать в клетке различные структуры, которые отражают характер ее функциональной специализации. Различают следующие структуры:
1. Микроворсинки – выпячивание цитоплазмы, покрытые плазмолеммой. Цитоскелет микроворсинки сформирован пучком актиновых микрофиламент, которые вплетаются в терминальную сеть апикальной части клеток (рис. 5). Единичные микроворсинки на светооптическом уровне не видны. При наличии значительного их числа (до 2000-3000) в апикальной части клетки уже при световой микроскопии различают “ щеточную каемку”.
2. Реснички – располагаются в апикальной зоне клетки и имеют две части (рис. 6) : а) наружную - аксонему
б) внутреннюю – безальное тельце
Аксонема состоит из комплекса микротрубочек (9 + 1 пары) и связанных с ними белков. Микротрубочки образованы белком тубулином, а ручки – белком динеином – эти белки в совокупности формируют тубулин-динеиновый хемомеханический преобразователь.
Базальное тельце состоит из 9 триплетов микротрубочек, расположенных у основания реснички и служит матрицей при организации аксонемы.
3. Базальный лабиринт – это глубокие инвагинации базальной плазмолеммы с лежащими между ними митохондриями. Это механизм активного всасывания воды, а так же ионов против градиента концентрации.
1. Транспорт низкомолекулярных соединений осуществляется тремя способами:
1. Простая диффузия
2. Облегченная диффузия
Активный транспорт
Простая диффузия – низкомолекулярные гидрофобные органические соединения (жирные кислоты, мочевина) и нейтральные молекулы (Н О, СО, О). С увеличением разности концентраций между отсеками, разделенными мембраной, растет и скорость диффузии.
Облегченная диффузия – вещество идет через мембрану также по направлению градиента концентрации, но с помощью транспортного белка – транслоказы. Это интегральные белки, обладающие специфичностью в отношении переносимых веществ. Это, например, анионные каналы (эритроцит), К - каналы (плазмолемма возбужденных клеток) и Са - каналы (саркоплазматический ретикулум). Транслоказа для Н О – это аквапорин.
Механизм действия транслоказы:
1. Наличие открытого гидрофильного канала для веществ определенного размера и заряда.
2. Канал открывается только при связывании специфического лиганда.
3. Канала нет как такового, а сама молекула транслоказы, связав лиганд, поворачивается в плоскости мембраны на 180 .
Активный транспорт – это транспорт с помощью такого же транспортного белка (транслоказы), но против градиента концентрации. Это перемещение требует затрат энергии.
2. Транспорт через мембраны высокомолекулярных соединений
Переход частиц через плазмолемму происходит всегда в составе мембранного пузырька: 1. Эндоцитоз : а. пиноцитоз, б. фагоцитоз, в. эндоцитоз, опосредованный рецепторами.
Экзоцитоз: а. секреция, б. экскреция, в. рекреция – это перенос твердых веществ через клетку, здесь сочетается фагоцитоз и экскреция.
4. Мембранные белки, связанные с углеводами.
Периферические белки – белок-белковые взаимодействия.
Пример этих белков:
1. Спектрин
2. Фибронектин,
Белки –
интегральные белки выполняют следующие функции:
а) белки ионных каналов
б) рецепторные белки
Ионные каналы
аквопорины (эритроциты, почка, глаз).
Надмембранный компонент
Функция гликокаликса: 1. Играют рольрецепторов .
2. Межклеточное узнавание .
(адгезивные взаимодействия).
4. Рецепторы гистосовместимости.
5. Зона адсорбции ферментов (пристеночное пищеварение).
6. Рецепторы гормонов .
Подмембранный компонент
Структуры, формируемые плазмолеммой
Контуры клетки, даже на светооптическом уровне, не представляются ровными и гладкими, а электронная микроскопия позволила обнаружить и описать в клетке различные структуры, которые отражают характер ее функциональной специализации. Различают следующие структуры:
1. Микроворсинки – выпячивание цитоплазмы, покрытые плазмолеммой. Цитоскелет микроворсинки сформирован пучком актиновых микрофиламент, которые вплетаются в терминальную сеть апикальной части клеток (рис. 5). Единичные микроворсинки на светооптическом уровне не видны. При наличии значительного их числа (до 2000-3000) в апикальной части клетки уже при световой микроскопии различают “ щеточную каемку”.
2. Реснички – располагаются в апикальной зоне клетки и имеют две части (рис. 6) : а) наружную - аксонему
б) внутреннюю – безальное тельце
Аксонема состоит из комплекса микротрубочек (9 + 1 пары) и связанных с ними белков. Микротрубочки образованы белком тубулином, а ручки – белком динеином – эти белки в совокупности формируют тубулин-динеиновый хемомеханический преобразователь.
Базальное тельце состоит из 9 триплетов микротрубочек, расположенных у основания реснички и служит матрицей при организации аксонемы.
3. Базальный лабиринт – это глубокие инвагинации базальной плазмолеммы с лежащими между ними митохондриями. Это механизм активного всасывания воды, а так же ионов против градиента концентрации.
1. Транспорт низкомолекулярных соединений осуществляется тремя способами:
1. Простая диффузия
2. Облегченная диффузия
3. Активный транспорт
Простая диффузия – низкомолекулярные гидрофобные органические соединения (жирные кислоты, мочевина) и нейтральные молекулы (Н О, СО, О). С увеличением разности концентраций между отсеками, разделенными мембраной, растет и скорость диффузии.
Облегченная диффузия – вещество идет через мембрану также по направлению градиента концентрации, но с помощью транспортного белка – транслоказы. Это интегральные белки, обладающие специфичностью в отношении переносимых веществ. Это, например, анионные каналы (эритроцит), К - каналы (плазмолемма возбужденных клеток) и Са - каналы (саркоплазматический ретикулум). Транслоказа для Н О – это аквапорин.
Механизм действия транслоказы:
1. Наличие открытого гидрофильного канала для веществ определенного размера и заряда.
2. Канал открывается только при связывании специфического лиганда.
3. Канала нет как такового, а сама молекула транслоказы, связав лиганд, поворачивается в плоскости мембраны на 180 .
Активный транспорт – это транспорт с помощью такого же транспортного белка (транслоказы), но против градиента концентрации. Это перемещение требует затрат энергии.
Транспорт через мембраны высокомолекулярных соединений
Переход частиц через плазмолемму происходит всегда в составе мембранного пузырька: 1. Эндоцитоз : а. пиноцитоз, б. фагоцитоз, в. эндоцитоз, опосредованный рецепторами.
2. Экзоцитоз: а. секреция, б. экскреция, в. рекреция – это перенос твердых веществ через клетку, здесь сочетается фагоцитоз и экскреция.
Рецепторно-опосредованный эндоцитоз
1. Накопление лиганд-связывающих рецепторов в специфическом участке плазмалеммы – окаймленные ямки (один лиганд, один рецептор).
2. Поверхность ямки с цитозольной стороны покрыта аморфным плотным веществом –клатрином (этим путем попадают транспортные белки ЛНП, и белки, транспортирующие железо – трансферрин.
3. Образование окаймленного пузырька.
4. Слияние окаймленного пузырька с кислой эндосомой.
рис. Н эндосома
5. Судьба рецептора и лиганда определяется типом эндоцитоза.
а). Рецептор возвращается, лиганд разрушается.
рис. лизосома
б) Рецептор возвращается, лиганд возвращается.
рис. лизосома
в) Рецептор разрушается, лиганд разрушается.
рис. лизосома
г) Рецептор транспортируется, лиганд транспортируется.
рис. лизосома
Патология - Гиперхолестероломия
1. Повышение уровня ЛНП.
2. ЛНП не поглощаются клетками.
3. Уровень ЛНП в плазме.
4. Образуются атеросклеротические бляшки коронарных сосудов.
ЛЕКЦИЯ
ТЕМА “ ОРГАНЕЛЛЫ ОБЩЕГО ЗНАЧЕНИЯ “
Органеллы – это функциональные системы (аппараты) клетки. Выделяют следующие системы: 1 Синтетический аппарат
2. Энергетический аппарат
3. Аппарат внутриклеточного переваривания (эндосомальный – лизосомальный)
4. Цитоскелет
Гиалоплазма – это коллоидная система, которая составляет 55 % общего обьема клетки, в ней взвешены органеллы и включения, она содержит белки, полисахариды, нуклеиновые кислоты, ионы. Здесь происходит межуточный обмен.
Различают несколько видов эндоплазматической сети : 1. Шероховатая (гранулярная эндоплазматическая сеть) - ГЭС
2. Гладкая (агранулярная эндоплазматическая сеть) - АЭС
3. Промежуточная (система транспорта)
Гранулярная эндоплазматическая сеть – это система уплощенных цистерн, вакуолей и каналов, ограниченных мембранами, на поверхности которых располагаются рибосомы.
Рибосомы состоят из РНК и гистонов (1: 1), связаны с мембранами белком рибофорином. Значение: 1. Обьединяют в пространстве компоненты белка
2. Обеспечивают взаимное узнавание комплекса - рибосомальная РНК - тРНК
3. Предоставляют ферменты, катализирующие образование пептидных связей
Эндоплазматическая сеть – синтез белков, липидов и углеводов – посттрансляционные изменения.
Функции ГЭС : 1. Синтез мембранных белков
2. Синтез белков на экспорт
3. Начальные этапы гликозилирования
4. Посттрансляционные изменения
В процессе синтеза белка происходят изменения, обозначаемых следующими терминами:1. Инициация – это связывание м-РНК с рибосомами
2. Элонгация – удлинение пептидной цепи
3. Фолдинг – сворачивание пептидной цепи в правильную трехмерную структуру.
Светооптический аналог ГЭС – это феномен базофилии цитоплазмы, которая может проявляться в двух видах: а) диффузная окраска цитоплазмы,
б) наличие в клетке базофильно окрашенных глыбок и гранул.
При этом базофилия – это результат наличия на мембранах ГЭС рибосом, в состав которых входят остатки фосфорной кислоты (компонент триплета), который и инициирует отрицательный заряд, связывающий основный краситель (феномен базофилии).
Синтез белка : 1. Начинается синтезом на полисомах.
2. В результате взаимодействия и-РНК и рибосомы образуется сигнальный пептид (20-25 аминокислот).
3. Связывание сигнального пептида с рибонуклеопротеидным комплексом (СРЧ – сигнал-распознающая частица).
4. Это связывание прекращает синтез белка.
5. Связывание СРЧ со специфическим рецептором на мембране ЭПС (это так называемый причальный белок).
6. После связывания с рецептором мембраны СРЧ отделяется от полисом.
7. Происходит разблокирование синтеза белковой молекулы.
8. Интегральные белки-рецепторы – рибофорины- обеспечивают присоединение большой субьединицы рибосом.
9. В просвете ГЭПС сигнальный пептид отщепляется ферментом сигнальной пептидазой.
10. Внутри цистерны пептид подвергается посттрансляционной модификации:
гидроксилированию, фосфорилированию, сульфатированию и т.д.
Функции комплекса Гольджи
1. Синтез полисахаридов и гликопротеинов (гликокаликс, слизь).
2. Процессинг молекул:
а) терминальное гликозилирование
б) фосфорилирование
в) сульфатирование
г) протеолитическое расщепление (части белковых молекул)
3. Конденсация секреторного продукта.
4. Упаковка секреторного продукта
5. Сортировка белков в зоне сети транс- Гольджи (за счет специфических рецепторных мембранных белков, которые распознают сигнальные участки на макромолекулах и направляют их в соответствующие пузырьки). Транспорт из комплекса Гольджи идет в виде 3-х потоков:
1. Гидролазные пузырьки (или первичные лизосомы)
2. В плазмолемму (в составе окаймленных пузырьков)
3. В секреторные гранулы
Эндосомы - мембранные пузырьки с закисляющимся содержимым и обеспечивающие перенос молекул в клетку. Тип переноса веществ системой эндосом различный:
1. С перевариванием макромолекул (полным)
2. С частичным их расщеплением
3. Без изменения по ходу транспорта
Процесс транспорта и последующего расшепления веществ в клетке с помощью эндосом состоит из следующих последовательных компонентов:
1. Ранняя (периферическая) эндосома
2. Поздняя (перинуклеарная) эндосома прелизосомальный этап переваривания
3. Лизосома
Ранняя эндосома – лишенный клатрина пузырек на периферии клетки. рН среды 6,0, здесь происходит ограниченный и регулируемый процесс расщепления (лиганд отделяется от рецептора) --- возвращение рецепторов в мембрану клетки. Ранняя эндосома еще известна как Curl.
Поздняя (перинуклеарная) эндосома: а) более кислое содержимое рН 5,5
б) диаметр больший до 800 нм
в) более глубокий уровень переваривания
Это переваривание лиганд (периферическая эндосома + перинуклеарная эндосома) --- мультивезикулярное тельце.
Лизосомы
1. Фаголизосома – она формируется при слиянии поздней эндосомы или лизосомы с фагосомой. Процесс разрушения этого материала называется гетерофагией.
2.Аутофаголизосома – она формируется при слиянии поздней эндосомы или лизосомы с аутофагосомой.
3. Мультивезикулярное тельце – крупная вакуоль (800 нм) , состоящая из мелких 40-80 нм пузырьков, окруженных умеренно плотным матриксом. Оно образуется в результате слияния ранней и поздней эндосом.
4. Остаточные тельца - это непереваренный материал. Самым известным компонентом этого типа являются липофусциновые гранулы – пузырьки диам. 0,3 – 3 мкм, содержащие пигмент липофусцин.
Цитоскелет – это система микротрубочек, микрофиламентов (промежуточных, микротрабекул). Все они формируют трехмерную сеть, взаимодействуя с сетями из других компонентов.
1. Микротрубочки – полые цилиндры диам. 24-25 нм, стенка толщиной 5 нм, диам. просвета – 14-15 нм. Стенка состоит из спирально уложенных нитей (они называются протофиламенты) толщиной 5 нм. Эти нити образованы димерами и тубулина. Это лабильная система, у которой один конец (обозначаемый “__”) закреплен, а другой (“ + “) свободен и участвует в процессе деполимеризации.
Микротрубочки ассоциированы с рядом белков, имеющих общее название МАР – они связывают микротрубочки с другими элементами цитоскелета и органеллами. Кинезин –(шаг его перемещения по поверхности микротрубочки составляет 8 нм).
Органелла
рис. Микротрубочка
Микрофиламенты – это две переплетенные нити F-актина, составленные из g- актина. Диаметр их составляет 6 нм. Микрофиламенты полярны, присоединение g -актина происходит на (“+”) конце. Они образуют скопления
по периферии клетки и связаны с плазмолеммой посредством промежуточных белков (-актин, винкулин, талин).
Функция: 1. Изменение цитозоля (переход золя в гель и обратно).
2. Эндоцитоз и экзоцитоз.
3. Подвижность немышечных клеток.
4. Стабилизация локальных выпячиваний плазматической мембраны.
Промежуточные нити имеют d 8-11 нм, состоят из белков, характерных для определенных клеточных типов. Они формируют внутриклеточный каркас, обеспечивающий упругость клетки и упорядоченное расположение компонентов цитоплазмы. Промежуточные филаменты образованы нитевидными белковыми молекулами, сплетенными друг с другом наподобие каната.
Функции : 1. Структурная
2. Участие в образовании рогового вещества
3. Поддержание формы, отростков нервных клеток
4. Прикрепление миофибрилл к плазмолемме.
Микротрабекулы – ажурная сеть тонких нитей, существующая в комплексе с микротрубочками и может участвовать в транспорте органелл и влиять на вязкость цитозоля.
ЛЕКЦИЯ
ТЕМА:” ЯДРО. СТРУКТУРА ИНТЕРФАЗНОГО ЯДРА. ОСНОВЫ БИОСИНТЕТИЧЕСКОЙ ДЕЯТЕЛЬНОСТИ КЛЕТКИ”
Ядро является основной частью клетки, кодирующей информацию о структуре и функции органа. Эта информация заложена в генетическом материале, ДНК, представляющей собой в комплексе с основными белками (гистонами) ДНП. За некоторым исключением (митохондрии) ДНК локализуется исключительно в ядре. ДНК способна реплицироваться сама, обеспечивая тем самым передачу генетического кода дочерним клеткам в условиях клеточного деления.
Ядро играет центральную роль в синтезе белка и полипептидов, являясь носителем генетической информации. Все ядра клеток организма содержат те же самые гены, одни клетки различны по своей структуре, функции и характеру продуцируемых клеткой веществ. Ядерный контроль осуществляется путем
репрессии или депрессии (экспрессии) активности различных генов. Трансляция о характере синтеза белка связана с образованием м-РНК. Многие РНК – это комплекс белка и РНК, т.е. РНП. Интерфазное ядро в большинстве клеток – это образование округлой или овальной формы в несколько мм в диаметре. В лейкоцитах и клетках соединительной ткани ядро дольчатое и обозначается термином полиморфное.
Интерфазное ядро имеет несколько различных структур: ядерную оболочку, хроматин, кариолимфу и ядрышко.
Ядерная оболочка
1. Наружная ядерная мембрана – на поверхности расположены рибосомы, где синтезируются белки, поступающие в перинуклеарные цистерны. Со стороны цитоплазмы она окружена рыхлой сетью промежуточных (виментиновых) филаментов.
2. Перинуклеарные цистерны – часть околоядерных цистерн связана с гранулярной эндоплазматической сетью (20-50 нм).
3. Внутренняя ядерная мембрана – отделена от содержимого ядра ядерной пластинкой.
4. Ядерная пластинка толщиной 80-300 нм, участвует в организации ядерной оболочки и перинуклеарного хроматина, содержит белки промежуточных филаментов – ламины А, В и С.
5. Ядерная пора – от 3-4 тысяч специализированных коммуникаций, осуществляют транспорт между ядром и цитоплазмой. Ядерная пора d 80 нм, имеет: а) канал поры – 9 нм
б) комплекс ядерной поры, последний содержит белок-рецептор, реагирующий на сигналы ядерного импорта (входной билет в ядро).Диаметр ядерной поры может увеличивать диаметр канала поры и обеспечивать перенос в ядро больших макромолекул (ДНК-РНК – полимераза).
Ядерная пора состоит из 2-х параллельных колец по одному с каждой поверхности кариолеммы. Кольцо диаметром 80 нм, образованы они 8 белковыми гранулами, от каждой гранулы к центру тянется нить (5 нм), которая формирует перегородку (диафрагму). В центре расположена центральная гранула. Совокупность этих структур называется комплекс ядерной поры. Здесь формируется канал диаметром 9 нм, такой канал называют водным, поскольку по нему движутся мелкие водорастворимые молекулы и ионы.
Функции ядерной поры: 1. Избирательный транспорт;
2. Активный перенос в ядро белков с последовательностью, характерной для белков ядерной локализации;
3. Перенос в цитоплазму субьединиц рибосом с изменением конформации порового комплекса.
Внутренняя ядерная мембрана - гладкая и связана с помощью интегральных белков с ядерной пластинкой, которая представляет собой слой, толщиной 80-300 нм. Эта пластинка или ламина – состоит из переплетенных промежуточных филаментов (10 нм), формирующих кариоскелет. Функции ее:
1. Сохранение структурной организации поровых комплексов;
2. Поддержание формы ядра;
3. Упорядоченная укладка хроматина.
Она формируется в результате спонтанной ассоциации 3-х главных полипептидов. Это структурный каркас ядерной оболочки с участками специфического связывания хроматина.
Хроматин
Насветовом микроскопе состоит из нерегулярно упакованной массы невысокой плотности, различается степенью плотности, количеством и размерами в клетках различного типа. Глыбки хроматина обозначают термином кариосомы, т.е. они обладают сродством к основным красителям. Хроматин интерфазного ядра – это ДНП хромосом. Хромосомы в интерфазном ядре очень тонкие, длинные, напоминающие собой нити в клубке.
Было время когда считали, что эта масса состоит из одной индивидуальной хромосомы, которую называли спирелла.
Плотный хроматин обозначается термином гетерохроматин в противовес не свернутому эухроматину. На светооптическом уровне видны элементы хромосом лишь при условии, что они образуют агрегаты, размером 0,2 мкм (гетерохроматин). Масса гетерохроматина является показателем клеточной активности клетки, содержащие большие блоки гетерохроматина характеризуются неактивной фазой в синтезе белка и, следовательно, в продукции м-РНК.
Ядрышко
Это плотная гранула диаметром 1-3 мкм, интенсивно окрашивающаяся основными красителями. Главным компонентом ядрышка является специализированный участок хромосом (петли), или организатор ядрышка. Такие участки имеются в пяти хромосомах: 13-й, 14-й, 15-й, 21-й и 22-й; именно здесь располагаются многочисленные копии генов, кодирующих рибосомальные РНК.
При ЭМ в ядрышке описывают 3 компонента :
1. Фибриллярный компонент - множество тонких (5-8 нм) нитей, с преимущественной локализацией во внутренней части ядрышка. Это первичные транскрипты р-РНК.
2. Гранулярный компонент – это скопление плотных частиц диаметром 10-20 нм, они соответствуют наиболее зрелым предшественникам субьединиц рибосом.
3. Аморфный компонент – это зона расположения ядрышковых организаторов, очень бледно окрашенная зона. Здесь крупные петли ДНК, участвующие в транскрипции рибосомальной РНК, а так же белки, специфически связывающиеся с РНК. Гранулы и фибриллы формируют ядрышковую нить (нуклеолонему) , толщиной 60-80 нм. Поскольку ядрышко окружено хроматином, то он получает название перинуклеарный хроматин , а его часть, проникающая внутрь ядрышка – этоинтрануклеолярный хроматин.
Клеточный конвейер – это сборка секреторного продукта на живой конвейерной ленте при участии различных клеточных органелл. При этом процесс сборки слагается из ряда этапов, происходящих в определенной последовательности на участках клетки, достаточно далеко удаленных от места непосредственного действия нуклеиновых кислот, осуществляющих генетический контроль.
Клеточный конвейер при синтезе белка предусматривает обычную последовательность процессов, изложенную в разделе описания гранулярной эндоплазматической сети. Здесь уместно представить механизм синтеза небелковых веществ.
Мембранные белки, связанные с липидами.
4. Мембранные белки, связанные с углеводами.
Периферические белки – не погружены в липидный бислой и не соединены с ним ковалентно. Они удерживаются за счет ионных взаимодействий. Периферические белки ассоциированы с интегральными белками в мембране за счет взаимодействия - белок-белковые взаимодействия.
Пример этих белков:
1. Спектрин , который расположен на внутренней поверхности клетки
2. Фибронектин, локализован на наружной поверхности мембраны
Белки – обычно составляют до 50% массы мембраны. При этом
интегральные белки выполняют следующие функции:
а) белки ионных каналов
б) рецепторные белки
2. Периферические мембранные белки (фибриллярные, глобулярные) выполняют функции:
а) наружные (рецепторные и адгезионные белки)
б) внутренние – белки цитоскелета (спектрин, анкирин), белки системы вторых посредников.
Ионные каналы – это сформированные интегральными белками каналы, они формируют небольшую пору, через которую по электрохимическому градиенту проходят ионы. Наиболее известные каналы – это каналы для Nа, К, Са 2 , Сl.
Существуют и водные каналы – это аквопорины (эритроциты, почка, глаз).
Надмембранный компонент – гликокаликс, толщина 50 нм. Это углеводные участки гликопротеинов и гликолипидов, обеспечивающие отрицательный заряд. Под ЭМ – это рыхлый слой умеренной плотности, покрывающий наружную поверхность плазмолеммы. В состав гликокаликса помимо углеводных компонентов входят периферические мембранные белки (полуинтегральные). Функциональные участки их находятся в надмембранной зоне- это иммуноглобулины (рис. 4) .
Функция гликокаликса: 1. Играют рольрецепторов .
2. Межклеточное узнавание .
3. Межклеточные взаимодействия (адгезивные взаимодействия).
4. Рецепторы гистосовместимости.
5. Зона адсорбции ферментов (пристеночное пищеварение).
6. Рецепторы гормонов .
Подмембранный компонент или самая наружная зона цитоплазмы, обычно обладает относительной жесткостью и эта зона особенно богата филаментами (d 5-10 нм). Предполагают, что интегральные белки, входящие в состав клеточной мембраны, прямо или косвенно связаны с актиновыми филаментами, лежащими в подмембранной зоне. При этом экспериментально доказано, что при агрегации интегральных белков, находящийся в этой зоне актин и миозин также агрегируют, что указывает на участие актиновых филамент в регуцляции формы клетки.
Синтез белка
Важнейшие функции организма: обмен веществ, развитие, рост,
движение – осуществляются биохимическими реакциями с участием белков.
Поэтому в клетках непрерывно синтезируются белки: белки-ферменты, белки-
гормоны, сократительные белки, защитные белки.
Первичная структура белка (порядок расположения аминокислот в белке) закодирована в молекулах ДНК. Каждый триплет (группа из трех соседних нуклеотидов) кодирует на нити ДНК одну определенную аминокислоту из двадцати.
Последовательность триплетов на нити ДНК представляет собой генетический код.
Зная последовательность триплетов на нити ДНК, то есть генетический код, можно установить последовательность соединения аминокислот в белке.
К настоящему времени расшифрованы триплеты для всех двадцати
аминокислот.
Например
Аминокислоту лизин кодирует на нити ДНК триплет ТТТ.
Аминокислоту триптофан кодирует триплет АЦЦ и т.д.
В одной молекуле ДНК может быть закодированы несколько разных белков. Участок ДНК, на котором закодирован белок, называют геном.
Участки ДНК отделяются друг от друга специальными триплетами, которые являются знаками препинания. Они означают начало и окончание синтеза белка.
Поскольку ДНК,в которой хранится генетическая информация о белке не
принимает непосредственного участия в синтезе белка, содержится в ядре, а
синтез белка происходит в цитоплазме на рибосомах, существует посредник-
иРНК. иРНК считывает генетическую информацию о белке с участка ДНК и
передает эту информацию с нити ДНК на рибосому. иРНК синтезируется на участке ДНК по принципу комплементарности.
Напротив азотистого основания аденин (А) на нити ДНК располагается урацил
(У) на нити иРНК, напротив азотистого основания тимин (Т) на нити ДНК
располагается аденин (А) на иРНК, напротив азотистого основания гуанин (Г)
на нити ДНК располагается цитазин (Ц).
Процесс считывания иРНК генетической информации о белке с участка ДНК называется транскрипцией. Этот процесс протекает как матричный синтез, так как одна из нитей ДНК является матрицей.
Синтез белка происходит на рибосомах. На нити иРНК располагается обычно группа рибосом. Такую группу рибосом называют полисомой.
Рибосомы продвигаются на нити иРНК от триплета к триплету.
Каждый триплет на нити иРНК кодирует одну определенную аминокислоту из
двадцати аминокислот.
Транспортные РНК присоединяют определенные аминокислоты (каждая тРНК присоединяет одну определенную аминокислоту) и приносит их к рибосомам.
При этом антикодон каждой тРНК должен быть комплементарен одному
из триплетов (кодонов) на иРНК.
Например
Антикодон АГЦ на тРНК должен быть комплементарен кодону УГЦ на нити иРНК. рРНК вместе с белками –ферментами учавствует в соединении аминокислот друг с другом, в результате чего на рибосомах синтезируется определенный белок.
Этот процесс называется трансляцией.
Достигнув конечного участка на нити иРНК, рибосомы отделяются от нити РНК. Отсинтезированная молекула белка имеет первичную структуру. Затем она приобретает вторичную, третичную и четвертичную структуры.
В синтезе белка принимают участие большое кол-во ферментов. На синтез белка расходуется энергия АТФ.
Белок затем поступает в каналы эндоплазматической сети, в котором транспортируется к определенным участкам клетки.
Клетки эукариот обладают развитой системой внутренних структур, окруженных мембранами, которые называются органеллами
Каждая органелла обладает уникальным составом (глико)протеинов и (глико)липидов и выполняет определенный набор функций
Каждая органелла содержит один или несколько компартментов, ограниченных мембранами
Органеллы выполняют свои функции автономно или в группах
При эндоцитозе и экзоцитозе переносимые белки (белки карго) транспортируются между компартментами через транспортные везикулы, которые образуются отпочковыванием от поверхности органеллы и затем сливаются с мембраной-мишенью акцепторного компартмента
Транспортные везикулы могут избирательно включать переносимый материал и исключать те компоненты, которые должны оставаться в органелле, из которой везикулы образовались
Селективное включение в везикулы обеспечивается сигналами, присутствующими в первичной структуре белка или в углеводной структуре
Транспортные везикулы содержат белки, которые направляют их к местам назначения и связывания. В дальнейшем везикулы сливаются с акцепторным участком мембраны
Компартменты, ограниченные мембранами в типичной клетке животных.Одной из характерных особенностей эукариотической клетки является присутствие в ней развитой системы внутренних структур, окруженных мембранами, которые называются органеллы. Для клеток эукариот характерно присутствие мембран, разделяющих их внутреннее содержимое на функционально-различные компартменты, тогда как все клетки живых организмов обладают наружной двухслойной мембраной.
Одно из преимуществ компартментализации состоит в том, что клетка имеет возможность создавать необходимое окружение для выполнения функций, требующих определенного химического состава среды.
На проиллюстрировано строение и разнообразие органелл , имеющих мембрану, которые обычно присутствуют в эукариотической клетке (в данном случае в типичной животной клетке). Каждая органелла содержит один или несколько компартментов. Например, эндоплазматический ретикулум (ЭПР) представляет собой один компартмент; напротив, аппарат Гольджи состоит из нескольких окруженных мембранами компартментов, обладающих определенными биохимическими функциями.
Для митохондрии характерны два компартмента , матрикс и межмембранное пространство, содержащие набор определенных макромолекул.
Цитозоль может считаться одним компартментом , ограниченным плазматической мембраной и находящимся в контакте с наружной частью мембраны всех внутриклеточных органелл. Цитоплазма состоит из цитозоля и органелл. Аналогичным образом, нуклеоплазма ограничена внутренней ядерной мембраной.
Каждая органелла содержит уникальный набор белков (как мембранных, так и растворимых), липидов и других молекул, необходимых для выполнения ее функций. Некоторые липиды и белки ковалентно связаны с олигосахаридами. По мере роста и деления клеток должны синтезироваться их новые компоненты, необходимые для роста, деления и окончательного распределения внутриклеточного материала между двумя дочерними клетками. При дифференцировке и развитии клетки, а также в ответ на воздействие таких внешних факторов, как стресс, происходит синтез компонентов органелл.
Однако компоненты не всегда образуются в той органелле, где они функционируют. Обычно различные макромолекулы образуются в сайтах, специально предназначенных для их синтеза. Например, большинство белков образуются на рибосомах цитозоля, который является оптимальной средой для функционирования рибосом и синтеза белка.
Возникает следующий вопрос: каким образом компоненты органелл попадают в места их функционирования? С начала 1970-х гг. этот вопрос являлся центральным в клеточной биологии. Как следует из рисунке ниже, существует, по крайней мере, восемь основных типов органелл, каждая из которых состоит из сотен или тысяч различных белков и липидов.
 Экзоцитоз и эндоцитоз.
Экзоцитоз и эндоцитоз.
В экзоцитозе участвуют эндоплазматический ретикулум (включая ядерную оболочку)
и аппарат Гольджи (представлена одна стопка цистерн).
Эндоцитоз происходит с участием ранних и поздних эндосом и лизосом.
Все эти молекулы должны транспортироваться в органеллы, в которых они выполняют свои функции. Большинство образуется в цитозоле, и поэтому возникает вопрос: как они доставляются в соответствующие органеллы или же выходят из клетки, если принадлежат к секретируемым белкам? Во многих случаях ответом на этот вопрос служит наличие в молекуле белка специальных сигналов, обычно называемых сигналами сортировки или сигналами адресования. Они представляют собой короткие последовательности аминокислот, присутствующие в первичной структуре тех белков, которые должны быть локализованы не в цитозоле. Каждый адрес назначения белковой молекулы связан с одним или несколькими различными видами сигналов.
Сигналы сортировки узнаются специальными системами клетки по мере продвижения белка к месту назначения. Как показано на рисунке ниже, существует два основных транспортных механизма: экзоцитоз (или секреторный путь) и эндоцитоз, при котором материал (карго) транспортируется из клетки и в клетку соответственно.
Для всех вновь синтезированных белков , предназначенных для секреции из клетки, или для поступления в органеллы путем экзо- или эндоцитоза на мембране ЭПР существует общая точка входа. Сигналами к транслокации белка через мембрану ЭПР служат сигнальные последовательности. В настоящей главе мы рассмотрим сигналы сортировки, которые направляют белки к местам их назначения.
Находясь в ЭПР , белок не может транспортироваться через цитоплазму, и единственным путем его попадания в другие органеллы, окруженные мембранами, является везикулярный транспорт. Транспортные везикулы в основном состоят из белков и липидов и, как говорят, «отпочковываются» от мембраны. После того как везикула отпочковалась, она сливается со следующим компартментом, находящимся на ее пути. Компартмент, из которого возникла везикула, обычно называется донорский компартмент (или исходный компартмент), а компартмент назначения (или целевой) обычно называется акцепторный компартмент.
Транспортные везикулы прямым или непрямым путем переносят белки из ЭПР ко всем остальным компартментам на пути экзо- или эндоцитоза. При эндоцитозе везикулы образуются на плазматической мембране. Эти везикулы транспортируют заключенный в них материал в эндосомы, из которых образуются другие везикулы, переносящие материал в другие компартменты. Таким образом, состав транспортных везикул различается в зависимости от их происхождения и компартмента назначения.
Везикулярный транспорт создает проблему для органелл, с которыми обмениваются везикулы. Для нормального функционирования должен поддерживаться определенный внутренний состав органелл. Однако каким образом этого можно достичь, если везикулы все время изменяют этот состав? Масштаб проблемы становится очевидным при расчете эффективности транспорта. По пути эндоцитоза количество мембранных белков и липидов, эквивалентное их общему содержанию в плазматической мембране, способно транспортироваться через органеллы менее чем за час. Если сравнить со временем, необходимым для синтеза новой органеллы (обычно один день), то такая скорость впечатляет.
Решение этой проблемы связано с селективностью транспортного процесса. При отпочковывании в везикулу проходят только те белки, которые необходимо транспортировать. Резидентные белки органеллы в везикулу не попадают. Везикула удерживает эти белки и передает их следующей, находящейся на пути везикуле. Для поддержания гомеостаза между органеллами, по своей природе везикулярный транспорт всегда должен быть двунаправленным, т. е. компоненты донорского компартмента не должны непрерывно переноситься в акцепторный компартмент.