В водных растворах гидроксиды и соли проводят электрический ток в результате распада на заряженные частицы – ионы. Этот процесс носит название электролитическая диссоциация , а вещества, распадающиеся на ионы в водном растворе, называются электролитами.
Кислотами с точки зрения теории электролитической диссоциации называют вещества , распадающиеся в водных растворах на положительно заряженные ионы водорода (Н +) и отрицательно заряженные ионы кислотного остатка . Например, соляная кислота диссоциирует по уравнению
HCl↔H + + Cl - .
Положительно заряженные ионы называют катионами, а отрицательно заряженные – анионами. Таким образом, при диссоциации соляной кислоты образуется катион водорода и анион хлора (хлорид-ион ).
Число ионов водорода, образующихся при полной диссоциации молекулы кислоты, называется основностью кислоты .Так, соляная кислота является одноосновной , а серная кислота – двухосновной , т.к. при её диссоциации образуются два иона водорода:
Электролиты могут диссоциировать (распадаться на ионы) полностью, и такие вещества называют сильными электролитами. Электролиты, диссоциирующие частично, называют слабыми или средними. Серная, азотная и соляная кислоты относятся к сильным электролитам (сильным кислотам), а угольная кислота является слабой кислотой (слабым электролитом).
Основаниями с точки зрения теории электролитической диссоциации называют вещества, распадающиеся в водных растворах на положительно заряженные ионы металла и отрицательно заряженные гидроксид-ионы (ОН -) . Например, гидроксид натрия диссоциирует по уравнению
NaOH↔Na + + OH - .
Число гидроксид-ионов, образующихся при полной диссоциации молекулы основания, называется кислотностью основания. Так, гидроксид натрия является однокислотным , а гидроксид кальция – двухкислотным :
Ca(OH) 2 ↔ Ca 2+ + 2OH - .
Основания, как и все электролиты, могут быть сильными, слабыми и средней силы. Гидроксиды натрия, калия и кальция являются сильными основаниями, а гидроксид аммония – слабым основанием.
Амфотерные гидроксиды могут диссоциировать как кислоты и как основания:
Zn(OH) 2 ↔ Zn 2+ + 2OH - ;
Zn(OH) 2 ↔ 2H + + ZnO 2 2- .
В реакциях с кислотами амфотерные гидроксиды диссоциируют как основания, а в реакциях с основаниями – как кислоты.
Средние соли в водных растворах диссоциируют на катионы металла и анионы кислотного остатка:
Кислые соли могут диссоциировать частично:
или полностью с образованием кроме иона металла также катиона водорода:
Соответственно, основные соли также могут диссоциировать частично или полностью:
CaOHCl ↔ CaOH + + + Cl - ;
CaOHCl ↔ Ca 2+ + OH - + Cl - .
Большинство солей являются сильными электролитами.
1.11. Контрольные вопросы
1. Какие элементы 3-го периода ПСЭМ относятся к металлам? Ответ: натрий, магний, алюминий.
2. Какие элементы 4-й группы главной подгруппы относятся к неметаллам, полуметаллам, металлам?
Ответ: углерод, кремний – неметаллы, германий – полуметалл, олово и свинец – металлы.
3. Напишите уравнения реакций взаимодействия цинка (СО + 2), фосфора (СО + 5) и титана (СО + 4) с кислородом.
4. Напишите уравнения реакций взаимодействия кальция, фосфора (СО +3, и калия с хлором.
5. Напишите уравнения реакции взаимодействия оксида фосфора(V) и оксида магния с водой.
6. Напишите уравнение реакции взаимодействия оксида магния с оксидом углерода (IV).
7. Напишите уравнения реакций взаимодействия оксида алюминия с оксидом натрия и оксидом серы (VI).
8. Напишите уравнение реакции взаимодействия соляной кислоты с алюминием.
9. Напишите уравнение реакции взаимодействия азотной кислоты с оксидом алюминия.
10. Напишите уравнения реакций взаимодействия серной кислоты с гидроксидом калия и гидроксидом железа (II).
11. Напишите уравнение реакции взаимодействия гидроксида аммония с соляной кислотой.
12. Напишите уравнения реакций взаимодействия гидроксида натрия с оксидом серы (VI) и оксидом цинка (степень окисления цинка +2).
13. Напишите уравнение реакции взаимодействия сульфата железа (III) с едким натром, зная, что гидроксид железа (III) не растворим в воде.
14. Напишите уравнение реакции взаимодействия соляной кислоты с сульфитом натрия (Na 2 SO 3), зная, что сернистая кислота неустойчива и разлагается на воду и газообразный оксид серы (IV).
15. Напишите уравнение реакции взаимодействия сульфата натрия с хлоридом кальция, зная, что сульфат кальция не растворим в воде.
16. Напишите уравнения электролитической диссоциации азотной кислоты, гидроксида калия и хлорида магния.
17. Напишите уравнения электролитической диссоциации угольной кислоты, гидроксида магния и сульфата алюминия.
18. Напишите уравнения электролитической диссоциации фосфорной кислоты (H 3 PO 4) , гидроксида бария (Ba(OH) 2) и нитрата магния.
Какие вещества образуются при взаимодействии железа с разбавленной серной кислотой?
1) сульфат железа(III), вода и оксид серы(IV)
2) сульфат железа(II) и водород
3) сульфит железа(III) и водород
4) сульфид железа(II) и водород
Оксид кальция взаимодействует с
6. Раствор соляной кислоты реагирует с каждым из двух веществ:
1) AgNO 3 и Сu(ОН) 2
3) MgO и НВг
С раствором гидроксида натрия реагирует
И кислород, и водород вступают в реакцию с
NH 3 + O 2 → Н 2 O + NO
Коэффициент перед формулой восстановителя равен
10. Этилен характеризует следующее:
1) в молекуле содержится 2 атома углерода и 6 атомов водорода
2) молекула имеет плоскую форму
3) валентный угол равен 120°
4) не присоединяет водород и хлор
5) при гидратации образует уксусную кислоту
CuSO 4 + Nal -> Cul + Na 2 SO 4 + I 2 .
(9 класс)
11 вариант
2) Сl 2 + Н 2 = 2НСl
3) Сl 2 + 2KI = 2КСl + I 2
2. Сокращённое ионное уравнение Н + + ОН - = Н 2 O соответствует реакции
1) КОН + H 2 SO 4 →
2) NH 4 OH + H 2 SO 4 →
3) Fe(OH) 2 + H 2 SO 4 →
4) Ba(OH) 2 + H 2 SO 4 →
3. К слабым электролитам не относятся:
Магний легко растворяется в
1) дистиллированной воде
2) аммиачной воде
3) растворе НСl
4) растворе Na 2 CO 3
Какое из указанных веществ вступает в реакцию с оксидом фосфора(V)?
3) оксид углерода (IV)
4) оксид углерода (II)
При взаимодействии серебра с концентрированной азотной кислотой преимущественно образуются
1) нитрат серебра(I), водород, вода
2) вещества не взаимодействуют
3) оксид азота(IV), нитрат серебра(I), вода
4) оксид азота(IV), нитрит серебра(I), вода
Химическая реакция возможна между
1) Zn и СuСl 2
2) NaOH и К 3 РO 4
4) НСl и Ba(NO 3)
Взаимодействие натрия и кислорода преимущественно выражается уравнением
1) 4Na +O 2 = 2Na 2 O
3) 2Na + O 2 = Na 2 O 2
4) Na + O 2 = NaO 2
В уравнении окислительно-восстановительной реакции
Аl + Н 2 O → Аl(OН) 3 + Н 2
Коэффициент перед формулой окислителя равен
10. Стеариновая кислота:
1) имеет формулу С 17 Н 35 СООН
2) может взаимодействовать с глицерином
3) преимущественно входит в состав растительных жиров
4) хорошо растворяется в воде
5) взаимодействует с хлоридом натрия
Используя метод электронного баланса, составьте уравнение реакции
H 2 S + FeCl 3 → S + НСl + FeCl 2 .
Определите окислитель и восстановитель.
Итоговая контрольная работа по химии
(9 класс)
12 вариант
К окислительно-восстановительным реакциям относится взаимодействие между
1) оксидом натрия и водой
2) оксидом углерода(IV) и оксидом кальция
3) железом и хлоридом меди(II)
4) серной кислотой и нитратом бария
Молекулярному уравнению реакции
CuO + 2HNO 3 = Cu(NO 3) 2 + Н 2 O
Соответствует сокращённое ионное уравнение
1) CuO + 2HNO 3 = Сu 2+ + 2NO - + Н 2 O
2) CuO + 2Н + + 2NO 3 − = Сu 2+ + 2NO 3 - + Н 2 O
3) СuО + 2Н + = Сu 2+ + Н 2 O
4) О 2- + 2Н + = Н 2 O
3. К электролитам относится каждое из двух веществ:
1) гидроксид калия (р-р) и ацетат натрия (р-р)
2) оксид железа(III) и уксусная кислота (р-р)
3) хлорид бария (р-р) и фруктоза (р-р)
4) этанол (р-р) и карбонат кальция
Цинк быстро взаимодействует с водным раствором
При взаимодействии с водой образует кислоту
Гидроксид магния реагирует с
1) гидроксидом меди(II)
2) оксидом кальция
3) хлоридом калия
4) ортофосфорной кислотой
Какая схема соответствует практически неосуществимой реакции?
1) Сu + Fe(NO 3) 2 →
2) Mg + РbСl 2 →
3) Fe + CuSO 4 →
4) Cl 2 + NaBr →
8. Не реагируют друг с другом
1) хлор и водород
2) кислород и кальций
3) азот и вода
4) железо и сера
В уравнении реакции полного сгорания сероводорода в кислороде коэффициент перед формулой окислителя равен
10. Для этина характерны следующие реакции:
1) гидрирования и гидратации
2) гидратации и изомеризации
3) замещения атомов водорода на галоген и кислород
4) присоединения галогенов и азота
5) полимеризации и окисления
Используя метод электронного баланса, составьте уравнение реакции
HI + HNO 3(конц.) → HIO 3 + NO 2 + H 2 O.
Определите окислитель и восстановитель.
Итоговая контрольная работа по химии
(9 класс)
13 вариант
Окислительно-восстановительной реакцией не является
1) 2Cl 2 + 2Н 2 O = 4НСl + O 2
2) Сl 2 + Н 2 = 2НСl
3) Сl 2 + 2KI = 2КСl + I 2
4) НСl + AgNO 3 = AgCl + HNO 3
Задания №7 с решениями.
Разберем задания №7 из ОГЭ за 2016 год.
Задания с решениями.
Задание №1.
Только катионы калия и фосфат-анионы образуются при диссоциации вещества, формула которого
1. KHPO4
2. Ca3(PO4)2
3. KH2PO4
4. K3PO4
Объяснение: если при диссоциации образуются только катионы калия и фосфат-ионы, значит только эти ионы и входят в состав нужного вещества. Подтвердим уравнением диссоциации:
K3PO4 → 3K+ + PO4³‾
Правильный ответ - 4.
Задание №2.
К электролитам относится каждое из веществ, формулы которых
1. N2O, KOH, Na2CO3
2. Cu(NO3)2, HCl, Na2SO4
3. Ba(OH)2, NH3xH2O, H2SiO3
4. CaCl2, Cu(OH)2, SO2
Объяснение: электролиты - вещества, проводящие электрический ток вследствие диссоциации на ионы в растворах и расплавах. Следовательно, электролиты - растворимые вещества.
Правильный ответ - 2.
Задания №3.
При полной диссоциации сульфида натрия образуются ионы
1. Na+ и HS‾
2. Na+ и SO3²‾
3. Na+ и S²‾
4. Na+ и SO4²‾
Объяснение: напишем уравнение диссоциации сульфида натрия
Na2S → 2Na+ + S²‾
Следовательно, правильный ответ - 3.
Задания №4.
В перечне ионов
А. Нитрат-ион
Б. Ион аммония
В. Гидроксид-ион
Г. Ион водорода
Д. Фосфат-ион
Е. Ион магния
катионами являются:
1. БГД 2. БГЕ 3. АГЕ 4. ВГЕ
Объяснение: катионы-положительные частицы, например, ионы металлов или ион водорода. Из перечисленных - это ион аммония, ион водорода и магния. Правильный ответ - 2.
Задания №5.
Верны ли следующие суждения об электролитической диссоциации солей?
А. Все соли при диссоциации образуют катионы металлов, катионы водорода и анионы кислотных остатков
Б. Соли в процессе диссоциации образуют катионы металлов и анионы кислотных остатков
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
Объяснение: только кислые соли при диссоциации образуют катионы водорода, следовательно, А-неверно, а вот Б - верно. Приведем пример:
NaCl → Na+ + Cl‾
Правильный ответ - 2.
Задания №6.
Одинаковое число молей катионов и анионов образуется при полной диссоциации в водном растворе 1 моль
1. KNO3
2. CaCl2
3. Ba(NO3)2
4. Al2(SO4)3
Объяснение: в этом уравнении мы можем либо написать уравнения диссоциации и посмотреть на полученные коэффициенты, либо посмотреть на индексы в формулах данных солей. Одинаковое число молей есть только у молекулы KNO3:
KNO3 → K+ + NO3‾
Правильный ответ - 1.
Задание №7.
Хлорид-ионы образуются в процессе диссоциации вещества, формула которого
1. KClO3
2. AlCl3
3. NaClO
4. Cl2O7
Объяснение: среди приведенных веществ хлорид-ионы есть только в молекуле хлорида алюминия - AlCl3. Приведем уравнение диссоциации этой соли:
AlCl3 → Al3+ + 3Cl‾
Правильный ответ - 2.
Задание №8.
Ионы водорода образуются при диссоциации вещества, формула которого
1. H2SiO3
2. NH3xH2O
3. HBr
4. NaOH
Объяснение: ионы водорода входят, среди перечисленных, только в HBr: HBr → H+ + Br‾
(H2SiO3 в растворе диссоциирует на Н2О и SiO2)
Правильный ответ - 3.
Задание №9.
В перечне веществ:
А. Серная кислота
Б. Кислород
В. Гидроксид калия
Г. Глюкоза
Д. Сульфат натрия
Е. Этиловый спирт
к электролитам относятся:
1. ГДЕ 2. АБГ 3. ВДЕ 4. АВД
Объяснение: электролиты - это сильные кислоты, основания или соли. Среди перечисленных - это серная кислота (H2SO4), гидроксид калия (KOH), сульфат натрия (Na2SO4). Правильный ответ - 4.
Задание №10.
В процессе диссоциации фосфат-ионы образуют каждое из веществ, формулы которых
1. H3PO4, (NH4)3PO4, Cu3(PO4)2
2. Mg3(PO4)2, Na3PO4, AlPO4
3. Na3PO4, Ca3(PO4)2, FePO4
4. K3PO4, H3PO4, Na3PO4
Объяснение: как и в предыдущем задании, здесь нам нужно знать, что электролиты - это сильные кислоты или растворимые соли, как, например, в №4:
K3PO4 → 3K+ + PO4³‾
H3PO4 → 3H+ + PO4³‾
Na3PO4 → 3Na+ + PO4³‾
Правильный ответ - 4.
Задания для самостоятельного решения.
1. Ионы водорода и кислотного остатка образуются в процессе электролитической диссоциации:
1. Воды
2. Азотной кислоты
3. Кремниевой кислоты
4. Нитрата калия
2. Электролитами является каждое из веществ, формулы которых:
1. KOH, H2O(дист), CaCl2
2. BaSO4, Al(NO3)3, H2SO4
3. BaCl2, H2SO4, LiOH
4. H2SiO3, AgCl, HCl
3. Верны ли следующие суждения об электролитах?
А. Азотная и серная кислоты являются сильными электролитами
Б. Сероводород в водном растворе полностью распадается на ионы
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
4. Электролитом является каждое из двух веществ
1. Сульфид меди (II) и этанол
2. Соляная кислота и сульфат калия
3. Оксид ртути (II)и сульфат кальция
4. Карбонат магния и оксид азота (I)
5. В водном растворе ступенчато диссоциирует
1. Нитрат меди (II)
2. Азотная кислота
3. Серная кислота
4. Гидроксид натрия
6. Верны ли следующие суждения об электролитах
А. Гидроксид бериллия и гидроксид железа (III) являются сильными электролитами
Б. Нитрат серебра в водном растворе полностью распадается на ионы
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
7. Сульфат-ионы образуются в процессе диссоциации
1. Сульфида калия
2. Сероводородной кислоты
3. Сульфида меди
4. Сульфата бария
8. Общие химические свойства гидроксида натрия и гидроксида бария обусловлены
1. Наличием в их растворах ионов натрия и бария
2. Их хорошей растворимостью в воде
3. Наличием в их составе трех элементов
4. Наличием в их растворах гидроксид-ионов
9. Катионом является
1. Сульфат-ион
2. Ион натрия
3. Сульфид-ион
4. Сульфит-ион
10. Анионом является
1. Ион кальция
2. Силикат-ион
3. Ион магния
4. Ион аммония
Предоставленные задания были взяты из сборника для подготовки к ОГЭ по химии авторов: Корощенко А.С. и Купцовой А.А.
Электролиты и неэлектролиты
Из уроков физики известно, что растворы одних веществ способны проводить электрический ток, а других - нет.
Вещества, растворы которых проводят электрический ток, называются электролитами .
Вещества, растворы которых не проводят электрический ток, называются неэлектролитами . Например растворы сахара, спирта, глюкозы и некоторых других веществ не проводят электрический ток.
Электролитические диссоциация и ассоциация
Почему же растворы электролитов проводят электрический ток?
Шведский ученый С. Аррениус, изучая электропроводность различных веществ, пришел в 1877 г. к выводу, что причиной электропроводности является наличие в растворе ионов , которые образуются при растворении электролита в воде.
Процесс распада электролита на ионы называется электролитической диссоциацией .
С. Аррениус, который придерживался физической теории растворов, не учитывал взаимодействия электролита с водой и считал, что в растворах находятся свободные ионы. В отличие от него русские химики И. А. Каблуков и В. А. Кистяков- ский применили к объяснению электролитической диссоциации химическую теорию Д. И. Менделеева и доказали, что при растворении электролита происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы . Они считали, что в растворах находятся не свободные, не «голые» ионы, а гидратированные, т. е. «одетые в шубку» из молекул воды.
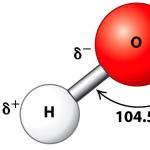
Молекулы воды представляют собой диполи (два полюса), так как атомы водорода расположены под углом 104,5°, благодаря чему молекула имеет угловую форму. Молекула воды схематически представлена ниже.

Как правило, легче всего диссоциируют вещества с ионной связью и, соответственно, с ионной кристаллической решеткой, так как они уже состоят из готовых ионов. При их растворении диполи воды ориентируются противоположно заряженными концами вокруг положительных и отрицательных ионов электролита.
Между ионами электролита и диполями воды возникают силы взаимного притяжения . В результате связь между ионами ослабевает, и происходит переход ионов из кристалла в раствор. Очевидно, что последовательность процессов, происходящих при диссоциации веществ с ионной связью (солей и щелочей), будет такой:
1) ориентация молекул (диполей) воды около ионов кристалла;
2) гидратация (взаимодействие) молекул воды с ионами поверхностного слоя кристалла;
3) диссоциация (распад) кристалла электролита на гидратированные ионы.
Упрощенно происходящие процессы можно отразить с помощью следующего уравнения:

Аналогично диссоциируют и электролиты, в молекулах которых ковалентная связь (например, молекулы хлороводорода HCl, смотри ниже); только в этом случае под влиянием диполей воды происходит превращение ковалентной полярной связи в ионную; последовательность процессов, происходящих при этом, будет такой:
1) ориентация молекул воды вокруг полюсов молекул электролита;
2) гидратация (взаимодействие) молекул воды с молекулами электролита;
3) ионизация молекул электролита (превращение ковалентной полярной связи в ионную);
4) диссоциация (распад) молекул электролита на гидратированные ионы.

Упрощенно процесс диссоциации соляной кислоты можно отразить с помощью следующего уравнения:

Следует учитывать, что в растворах электролитов хаотически движущиеся гидратированные ионы могут столкнуться и вновь объединиться между собой. Этот обратный процесс называется ассоциацией. Ассоциация в растворах происходит параллельно с диссоциацией, поэтому в уравнениях реакций ставят знак обратимости.

Свойства гидратированных ионов отличаются от свойств негидратированных. Например, негидратированный ион меди Cu 2+ - белый в безводных кристаллах сульфата меди (II) и имеет голубой цвет, когда гидратирован, т. е. связан с молекулами воды Cu 2+ nH 2 O. Гидратированные ионы имеют как постоянное, так и переменное число молекул воды.
Степень электролитической диссоциации
В растворах электролитов наряду с ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации , которая обозначается греческой буквой а («альфа»).
Это отношение числа частиц, распавшихся на ионы (N g), к общему числу растворенных частиц (N p).

Степень диссоциации электролита определяется опытным путем и выражается в долях или процентах. Если а = 0, то диссоциация отсутствует, а если а = 1, или 100 %, то электролит полностью распадается на ионы. Различные электролиты имеют различную степень диссоциации, т. е. степень диссоциации зависит от природы электролита. Она также зависит и от концентрации: с разбавлением раствора степень диссоциации увеличивается.
По степени электролитической диссоциации электролиты делятся на сильные и слабые.




Сильные электролиты - это электролиты, которые при растворении в воде практически полностью диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к единице.
К сильным электролитам относятся:
1) все растворимые соли;
2) сильные кислоты, например: H 2 SO 4 , HCl, HNO 3 ;
3) все щелочи, например: NaOH, KOH.
Слабые электролиты - это такие электролиты, которые при растворении в воде почти не диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к нулю.
К слабым электролитам относятся:
1) слабые кислоты - H 2 S, H 2 CO 3 , HNO 2 ;
2) водный раствор аммиака NH 3 H 2 O;
4) некоторые соли.

Константа диссоциации
В растворах слабых электролитов вследствие их неполной диссоциации устанавливается динамическое равновесие между недиссоциированными молекулами и ионами . Например, для уксусной кислоты:
Можно применить к этому равновесию закон действующих масс и записать выражение константы равновесия:

Константу равновесия, характеризующую процесс диссоциации слабого электролита, называют константой диссоциации .
Константа диссоциации характеризует способность электролита (кислоты, основания, воды) диссоциировать на ионы . Чем больше константа, тем легче электролит распадается на ионы, следовательно, тем он сильнее. Значения констант диссоциации для слабых электролитов приводятся в справочниках.
Основные положения теории электролитической диссоциации

1. При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы.
Ионы - это одна из форм существования химического элемента. Например, атомы металла натрия Na 0 энергично взаимодействуют с водой, образуя при этом щелочь (NaOH) и водород Н 2 , в то время как ионы натрия Na + таких продуктов не образуют. Хлор Cl 2 имеет желтозеленый цвет и резкий запах, ядовит, а ионы хлора Cl — бесцветны, не ядовиты, лишены запаха.
Ионы - это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов одного или нескольких химических элементов в результате отдачи или присоединения электронов.
В растворах ионы беспорядочно передвигаются в различных направлениях.
По составу ионы делятся на простые - Cl — , Na + и сложные - NH 4 + , SO 2 — .
2. Причиной диссоциации электролита в водных растворах является его гидратация, т. е. взаимодействие электролита с молекулами воды и разрыв химической связи в нем.
В результате такого взаимодействия образуются гидратированные, т. е. связанные с молекулами воды, ионы. Следовательно, по наличию водной оболочки ионы делятся на гидратированные (в раствоpax и кристаллогидратах) и негидратированные (в безводных солях).
3. Под действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу источника тока - катоду и поэтому называются катионами, а отрицательно заряженные ионы движутся к положительному полюсу источника тока - аноду и поэтому называются анионами.
Следовательно, существует еще одна классификация ионов - по знаку их заряда .
Сумма зарядов катионов (Н + , Na + , NH 4 + , Cu 2+) равна сумме зарядов анионов (Cl — , OH — , SO 4 2-), вследствие чего растворы электролитов (HCl, (NH 4) 2 SO 4 , NaOH, CuSO 4) остаются электронейтральными.
4. Электролитическая диссоциация - процесс обратимый для слабых электролитов.
Наряду с процессом диссоциации (распад электролита на ионы) протекает и обратный процесс - ассоциация (соединение ионов). Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости, например:

5. Не все электролиты в одинаковой мере диссоциируют на ионы.
Зависит от природы электролита и его концентрации. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
Свойства растворов слабых электролитов обусловлены молекулами и ионами, образовавшимися в процессе диссоциации, которые находятся в динамическом равновесии друг с другом.
Запах уксусной кислоты обусловлен наличием молекул CH 3 COOH, кислый вкус и изменение окраски индикаторов связаны с наличием в растворе ионов H + .
Свойства растворов сильных электролитов определяются свойствами ионов, которые образуются при их диссоциации.
Например, общие свойства кислот, такие как кислый вкус, изменение окраски индикаторов и др., обусловлены наличием в их растворах катионов водорода (точнее, ионов оксония H 3 O +). Общие свойства щелочей, такие как мылкость на ощупь, изменение окраски индикаторов и др. связаны с присутствием в их растворах гидроксид-ионов OH — , а свойства солей - с распадом их в растворе на катионы металла (или аммония) и анионы кислотных остатков.
Согласно теории электролитической диссоциации все реакции в водных растворах электролитов являются реакциями между ионами . Этим обусловлена высокая скорость многих химических реакций в растворах электролитов.
Реакции, протекающие между ионами, называют ионными реакциями
, а уравнения этих реакций - ионными уравнениями
.

Реакции ионного обмена в водных растворах могут протекать:
1. Необратимо , до конца.
2. Обратимо , то есть протекать одновременно в двух противоположных направлениях. Реакции обмена между сильными электролитами в растворах протекают до конца или практически необратимы, когда ионы, соединяясь друг с другом, образуют вещества:
а) нерастворимые;
б) малодиссоциирующие (слабые электролиты);
в) газообразные.
Приведем несколько примеров молекулярных и сокращенных ионных уравнений:

Реакция необратима , т. к. один из ее продуктов - нерастворимое вещество.
Реакция нейтрализации необратима , т. к. образуется малодиссоциирующее вещество - вода.

Реакция необратима , т. к. образуется газ CO 2 и малодиссоциирующее вещество - вода.
Если среди исходных веществ и среди продуктов реакции имеются слабые электролиты или малорастворимые вещества, то такие реакции являются обратимыми, т. е. до конца не протекают.
В обратимых реакциях равновесие смещается в сторону образования наименее растворимых или наименее диссоциированных веществ.
Например:

Равновесие смещается в сторону образования более слабого электролита - H 2 O. Однако до конца такая реакция протекать не будет: в растворе остаются недиссоциированные молекулы уксусной кислоты и гидроксид-ионы.
Если исходные вещества - сильные электролиты, которые при взаимодействии не образуют нерастворимых или малодиссоциирующих веществ или газов, то такие реакции не протекают: при смешивании растворов образуется смесь ионов.
Справочный материал для прохождения тестирования:
Таблица Менделеева
Таблица растворимости
Водные растворы некоторых веществ являются проводниками электрического тока. Эти вещества относятся к электролитам. Электролитами являются кислоты, основания и соли, расплавы некоторых веществ.
ОПРЕДЕЛЕНИЕ
Процесс распада электролитов на ионы в водных растворах и расплавах под действием электрического тока называется электролитической диссоциацией .
Растворы некоторых веществ в воде не проводят электрический ток. Такие вещества называют неэлектролитами. К ним относятся многие органические соединения, например сахар и спирты.
Теория электролитической диссоциации
Теория электролитической диссоциации была сформулирована шведским ученым С. Аррениусом (1887 г.). Основные положения теории С. Аррениуса:
— электролиты при растворении в воде распадаются (диссоциируют) на положительно и отрицательно заряженные ионы;
— под действием электрического тока положительно заряженные ионы движутся к катоду (катионы), а отрицательно заряженные – к аноду (анионы);
— диссоциация – обратимый процесс
КА ↔ К + + А −
Механизм электролитической диссоциации заключается в ион-дипольном взаимодействии между ионами и диполями воды (рис. 1).
Рис. 1. Электролитическая диссоциация раствора хлорида натрия
Легче всего диссоциируют вещества с ионной связью. Аналогично диссоциация протекает у молекул, образованных по типу полярной ковалентной связи (характер взаимодействия – диполь-дипольный).
Диссоциация кислот, оснований, солей
При диссоциации кислот всегда образуются ионы водорода (H +), а точнее – гидроксония (H 3 O +), которые отвечают за свойства кислот (кислый вкус, действие индикаторов, взаимодействие с основаниями и т.д.).
HNO 3 ↔ H + + NO 3 −
При диссоциации оснований всегда образуются гидроксид-ионы водорода (OH −), ответственные за свойства оснований (изменение окраски индикаторов, взаимодействие с кислотами и т.д.).
NaOH ↔ Na + + OH −
Соли – это электролиты, при диссоциации которых образуются катионы металлов (или катион аммония NH 4 +) и анионы кислотных остатков.
CaCl 2 ↔ Ca 2+ + 2Cl −
Многоосновные кислоты и основания диссоциируют ступенчато.
H 2 SO 4 ↔ H + + HSO 4 − (I ступень)
HSO 4 − ↔ H + + SO 4 2- (II ступень)
Ca(OH) 2 ↔ + + OH − (I ступень)
+ ↔ Ca 2+ + OH −
Степень диссоциации
Среди электролитов различают слабые и сильные растворы. Чтобы охарактеризовать эту меру существует понятие и величина степени диссоциации (). Степень диссоциации – отношение числа молекул, продиссоциировавших на ионы к общему числу молекул. часто выражают в %.
К слабым электролитам относятся вещества, у которых в децимолярном растворе (0,1 моль/л) степень диссоциации меньше 3%. К сильным электролитам относятся вещества, у которых в децимолярном растворе (0,1 моль/л) степень диссоциации больше 3%. Растворы сильных электролитов не содержат непродиссоциировавших молекул, а процесс ассоциации (объединения) приводит к образованию гидратированных ионов и ионных пар.
На степень диссоциации оказывают особое влияние природа растворителя, природа растворенного вещества, температура (у сильных электролитов с повышением температуры степень диссоциации снижается, а у слабых – проходит через максимум в области температур 60 o С), концентрация растворов, введение в раствор одноименных ионов.
Амфотерные электролиты
Существуют электролиты, которые при диссоциации образуют и H + , и OH − ионы. Такие электролиты называют амфотерными, например: Be(OH) 2 , Zn(OH) 2 , Sn(OH) 2 , Al(OH) 3 , Cr(OH) 3 и т.д.
H + +RO − ↔ ROH ↔ R + + OH −
Ионные уравнения реакций
Реакции в водных растворах электролитов – это реакции между ионами – ионные реакции, которые записывают с помощью ионных уравнений в молекулярной, полной ионной и сокращенной ионной формах. Например:
BaCl 2 + Na 2 SO 4 = BaSO 4 ↓ + 2NaCl (молекулярная форма)
Ba 2+ + 2 Cl − + 2 Na + + SO 4 2- = BaSO 4 ↓ + 2 Na + + 2 Cl − (полная ионная форма)
Ba 2+ + SO 4 2- = BaSO 4 ↓ (сокращенная ионная форма)
Водородный показатель pH
Вода – слабый электролит, поэтому процесс диссоциации протекает в незначительной степени.
H 2 O ↔ H + + OH −
К любому равновесию можно применить закон действующих масс и записать выражение для константы равновесия:
K = /
Равновесная концентрация воды – величина постоянная, слеовательно.
K = = K W
Кислотность (основность) водного раствора удобно выражать через десятичный логарифм молярной концентрации ионов водорода, взятый с обратным знаком. Эта величина называется водородным показателем (рН).