Методы исследования в гистологии, цитологии и эмбриологии Часть I к.м.н., старший преподаватель М.Р. Гринева д.м.н., профессор С.Ю. Виноградов д.м.н., профессор С.В. Диндяев Ивановская государственная медицинская академия Кафедра гистологии, эмбриологии и цитологии далее
Оглавление Введение Методы исследования живых клеток и тканей Виды гистологических препаратов фиксированных клеток Изготовление гистологического препарата Гистологический препарат Взятие материала Фиксация материала Уплотнение материала Приготовление срезов Виды микротомов Окрашивание срезов Методы окрашивания Типы красителей Заключение срезов в консервирующую среду Методы микроскопии Световая микроскопия Устройство светового микроскопа Техника микроскопирования Темнопольная микроскопия Поляризационная микроскопия Фазово-контрастная микроскопия Флюоресцентная (люминесцентная) микроскопия Электронная микроскопия Рекомендуемая литература далееназад

Введение В современной гистологии, цитологии и эмбриологии применяются разнообразные методы исследования, позволяющие всесторонне изучать процессы развития, строения и функции клеток, тканей и органов. Главными этапами цитологического и гистологического анализа являются выбор объекта исследования подготовка его к микроскопированиюподготовка его к микроскопированию применение методов микроскопированияприменение методов микроскопирования качественный и количественный анализ изображения Объектами исследования служат гистологические препараты, изготовленные из живых или фиксированных клеток.гистологические препаратыживыхфиксированных клеток оглавлениедалее

Методы исследования живых клеток и тканей далее Изучение живых клеток и тканей позволяет получить наиболее полную информацию об их жизнедеятельности – проследить процессы движения, деления, разрушения, роста, дифференцировки и взаимодействия клеток, продолжительность их клеточного цикла, реактивные изменения в ответ на действие различных факторов. Методы Прижизненное в организме (in vivo) Прижизненное в культуре клеток и тканей (in vitro) Вживление прозрачных камер Прижизненная микроскопия Трансплантация Суспензионные культуры Монослойные культуры Культивирование in vivo оглавление назад

Виды гистологических препаратов фиксированных клеток Мазок ОтпечатокСрезПленка крови красного костного мозга спинно- мозговой жидкости слюны влагалищный и др. селезенки тимуса печени слизистой оболочки мочевого пузыря слизистой оболочки щеки и др. брюшины плевры мягкой мозговой оболочки соединительной ткани и др. далееоглавлениеназад тонкие (толщина более 1 мкм) полутонкие (толщина менее 1 мкм) ультратонкие (толщина менее 0,1 мкм)


Гистологический препарат далее Гистологические препаратыГистологические препараты, как правило, представляют собой срезы (толщиной 5-15 мкм) органов, тканей или клеток, окрашенные специальными гистологическими красителями. Гистологический препарат должен отвечать следующим требованиям: сохранять прижизненное состояние структур; быть достаточно тонким и прозрачным для изучения его под микроскопом в проходящем свете; быть контрастным, то есть изучаемые структуры должны под микроскопом четко определяться; препараты для световой микроскопии должны долго сохраняться и использоваться для повторного изучения. Процесс изготовления гистологического препарата включает включает следующие основные этапы: 1.Взятие и фиксация материалаВзятиефиксация материала 2.Уплотнение материалаУплотнение материала 3.Приготовление срезовПриготовление срезов 4.Окрашивание срезовОкрашивание срезов 5.Заключение срезов в прозрачную средуЗаключение срезов в прозрачную среду оглавление назад

Взятие материала Изготовление гистологического препарата производится из органов и тканей, полученных несколькими путями: биопсия (пунктат), операционным путем, секционный (трупный) материал, экспериментальный При этом должны учитываться следующие моменты: 1.Забор материала должен проводиться как можно раньше после смерти или забоя экспериментального животного, а при возможности от живого объекта (биопсия), чтобы лучше сохранились структуры клетки, ткани или органа. 2.Забор кусочков должен производиться острым инструментом, чтобы не травмировать ткани. 3.Толщина кусочка не должна превышать 5 мм, чтобы фиксирующий раствор мог проникнуть в толщу кусочка. 4.Обязательно производится маркировка кусочка (указывается наименование органа, номер животного или фамилия человека, дата забора и так далее). оглавление назад далее

Фиксация материала назад Цель фиксации материала – сохранение прижизненного морфологию клеток и тканей, предотвращение аутолиза и посмертных изменений. Фиксатор вызывает денатурацию белка и стабилизацию липидов и тем самым приостанавливает обменные процессы и сохраняет структуры в их прижизненном состоянии. Фиксация достигается чаще всего погружением кусочка в фиксирующие жидкости, которые могут быть простыми (формалин, спирты, глутаровый альдегид, ацетон) и сложными (раствор Карнуа, фиксатор Ценкера и др.). Фиксация может достигаться также замораживанием (охлаждением в струе СО 2, жидким азотом и др.). Подбор фиксаторов и продолжительность фиксации индивидуален для различных органов и тканей и обычно колеблется от 2 до 24 часов. оглавлениедалее

Уплотнение материала назад Целью этого этапа является придание исследуемому материалу такой плотности, которая позволит получить тонкие срезы необходимой толщины. Этого достигают двумя способами: Замораживание образца с последующей резкой на замораживающем микротоме. Пропитывание уплотняющими средами (парафин, эпоксидные смолы и др.) Основные этапы парафиновой проводки: Промывка материала проточной водопроводной водой для удаления фиксатора. Обезвоживание (дегидратация) материала в спиртах увеличива-ющейся концентрации (70, 80, 90, 96, абсолютный – 100%). Удаление спирта и подготовка материала к пропитыванию парафином обработкой растворителями парафина (ксилол и др.) и смесью парафина и ксилола (при температуре 37°С) Заливка в чистый расплавленный парафин (при температуре 56°С). Охлаждение парафина и формирование блоков. оглавлениедалее

Приготовление срезов назад Для изготовления тонких срезов заданной толщины в настоящее время используются специальные приборы – микротомы (для световой микроскопии) и ультрамикротомы (для электронной микроскопии).микротомы Специальные ножи микротомов позволяют получить срезы толщиной: 3-8 мкм из материала, залитого в парафин, мкм из материала, замороженного в камере микротома-криостата 0,08-0,1 мкм из материала, подготовленного для электронной микроскопии Полученные срезы помещают на предметные стекла (для световой микроскопии) или монтируются на специальные сеточки (для электронной микроскопии). оглавлениедалее

Виды микротомов ротационныйкриостатныйсанный заморажи- вающий для экспресс- диагностики, гистохимии изготовление серийных парафиновых срезов изготовление парафиновых срезов изготовление срезов при температуре -20°С и ниже для гистохимии и иммуноцито- химии вибротом изготовление срезов фикси- рованных и нефиксирован- ных тканей оглавление назад далее

Окрашивание срезов Клеточные структуры без специальной обработки, как правило, не различимы даже при большом увеличении микроскопа. Они бесцветны и прозрачны. Для выявления тканевых компонентов, отдельных клеток, внутриклеточных структур используют красители – вещества с высоким сродством к различным компонентам ткани и с определенными цветооптическими свойствами.красители Способность тканевых компонентов по-разному окрашиваться зависит от кислотно-основных (щелочных) свойств веществ, входящих в их состав. Перед окрашиванием срезы депарафинируют, проводя последовательно через растворитель парафина (ксилол), спирты нисходящей концентрации (100, 96, 90, 80, 70%) и помещают в воду. оглавление назаддалее

Специальные Методы окрашивания Общегисто- логические оглавлениеназад ИмпрегнацияГисто- химические выявление общего плана строения клеток, тканей, органов выявление специализи- рованных структур в клетках и тканях анализ химического состава клеток и межклеточного вещества выявление специализи- рованных структур в клетках и тканях далее

Импрегнация назад Метод выявления тканевых структур путем пропитывания объектов гистологического исследования растворами солей тяжелых и драгоценных металлов (например, азотнокислое серебро (серебрение), кобальт, хлористое золото (золочение), кадмий, осмиевым ангидрид и др.). Участки ткани, в которых происходит осаждение солей металлов на гистологических структурах, приобретают черный или бурый цвет в зависимости от количества и свойств восстановленного металла. оглавление Периферический нерв (поперечный срез). Импрегнация оксидом осмия Мультиполярный нейрон. Импрегнация нитратом серебра Мультиполярные нейроны. Импрегнация нитратом серебра далее

Основныекислыенейтральные основания, связываясь с кислотными соединениями гистологических структур, вызывают обычно их окрашивание в сине- фиолетовые цвета соединяясь с основными (щелочными) соединениями гистологических структур, окрашивают их в цвета красителя содержат как основные, так и кислые красящие компоненты базофилия нейтрофилия метахромазия оксифилия Типы общегистологических красителей назадоглавлениедалее

Базофилия Основные (щелочные) красители активно связываются со структурами, которые содержат кислоты и несут отрицательный заряд – например, ДНК, РНК. К ним, в частности, относятся гематоксилин, толуидиновый синий, тионин, метиленовый синий, азуры и др. Способность окрашиваться основными (щелочными) красителями называется базофилией (от греч. basis – основа и philia – любовь). базофилией Поэтому структуры, связывающие эти красители, называются базофильными. В клетке базофилией обладает ядро (вследствие высокого содержания ДНК и РНК), иногда цитоплазма (при высоком содержании в ней рибосом или гранулярной ЭПС). Базофильно может окрашиваться межклеточное вещество некоторых тканей – например, хрящевой. оглавление назаддалее Базофилия ядра нейтрофильного гранулоцита. Окраска по Романовскому-Гимзе. Увеличение: х630.

Метахромазия Метахромазия (от греч. meta – изменение и chroma – цвет, краска) – изменение цвета некоторых основных красителей при их связывании со структурами, обладающими специфическими химическими свойствами (обычно высокой концентрацией сульфатированных гликозаминогликанов). К таким красителям относятся толуидиновый синий, азур II, тионин и др. Способность метахроматически окрашиваться обладают гранулы базофильных лейкоцитов, тучных клеток. Указанные красители окрашивают другие базофильные структуры в тех же тканях в обычный свойственный им цвет, т.е. ортохроматически (от греч. orthos – правильный и chroma – краска). оглавление назаддалее Метахромазия зернистости базофильного гранулоцита. Окраска по Романовскому-Гимзе. Увеличение: х630.

Оксифилия Кислые красители связываются со структурами, имеющими положительный заряд – например, белки. К таким красителям относятся эозин, оранж G, эритрозин, пикриновая кислота и др. Способность окрашиваться кислыми красителями называется оксифилией, или ацидофилией (от греч. oxys или лат. acidus – кислый и греч. philia – любовь).оксифилией Структуры, связывающие эти красители, называются оксифильными или ацидофильными. Оксифилия свойственна цитоплазме клеток (особенно при высоком содержании в ней митохондрий и некоторых белковых секреторных гранул), эритроцитам (благодаря высокой концентрации в них гемоглобина). Оксифильно окрашивается цитоплазма кардиомиоцитов, мышечных волокон скелетной мускулатуры, некоторые компоненты межклеточного вещества (например, коллагеновые волокна). оглавление назаддалее Оксифилия зернистости эозинофильного гранулоцита. Окраска по Романовскому-Гимзе. Увеличение: х630.

Нейтрофилия Нейтрофилия (от лат. neutrum – ни тот, ни другой, и philia - предрасположение, любовь) – способность гистологических структур окрашиваться и кислыми, и основными красителями. оглавление назаддалее Нейтрофилия зернистости нейтрофильного гранулоцита. Окраска по Романовскому-Гимзе. Увеличение: х630.

Заключение срезов в консервирующую среду назад Окрашенные гистологические препараты обезвоживаются в спиртах восходящей концентрации (70, 80, 90, 96, абсолютный – 100%) и просветвляются в ксилоле, бензоле, толуоле или некоторых маслах. Для длительного хранения обезвоженный гистологический срез заключают (монтируют) в прозрачную консервирующую среду (смолу хвойных деревьев – канадский, пихтовый бальзам, а также в синтетические среды). На постоянном гистологическом препарате срез ткани располагается на предметном стекле, сверху закрыт покровным стеклом. Между стеклами (предметным и покровным) находится заливочная среда, обладающая коэффициентом преломления световых лучей, близким к таковому у стекла. оглавлениедалее



Световая микроскопия далее Изучение гистологического препарата осуществляется в проходящем свете с помощью светового микроскопа.светового микроскопа Источник света естественный или искусственный (различные лампы). Свет собирается в конденсор и далее направляется через препарат в объектив. Окуляр дополнительно увеличивает это изображение.конденсоробъектив Окуляр Качество изображения (четкость) определяется разрешающей способностью микроскопа, т.е. минимальным (разрешающим) расстоянием, на котором оптика микроскопа позволяет различить раздельно две близко расположенные точки. Эта величина пропорциональна длине световой волны и для обычного светового микроскопа равна приблизительно 0,2 мкм. Чем меньше разрешающее расстояние, тем выше разрешающая способность микроскопа и тем более мелкие объекты можно исследовать. Увеличение микроскопа – это соотношение между истинными размерами исследуемого объекта и размерами его изображения, получаемого с помощью микроскопа. Ориентировочно оно оценивается как произведение увеличений объектива и окуляра и может достигать 2500 раз. объективаокуляра оглавлениеназад

Устройство светового микроскопа 1.Основание микроскопа 2.Тубусодержатель 3.Тубус 4.Окуляр (чаще ×7) 5.Револьвер микроскопа 6.Объективы а) сухие: ×8, ×20, ×40 б) иммерсионный ×90 7.Предметный столик 8.Конденсор 9.Макрометрический винт 10.Микрометрический винт 11.Винт конденсора 12.Зеркало Общее увеличение микроскопа = увеличение объектива × увеличение окуляра назадоглавление далее

Техника микроскопирования 1.Микроскопирование гистологического препарата начинают с установки правильного освещения. Для этого с помощью вогнутого зеркала, собирающего рассеянный пучок света, и конденсора достигают равномерного освещения поля зрения.вогнутого зеркалаконденсора 2.На предметный столик помещают гистологический препарат покровным стеклом вверх. 3.Изучение гистологического препарата начинают при малом увеличении (объектив х8), при этом расстояние между объективом и покровным стеклом должно быть около 1 см. Установку резкости проводят с помощью макровинта.малом увеличениимакровинта 4.Рассматривают детали гистологического препарата по всей площади, перемещая его на предметном столике. 5.Устанавливают в центр поля зрения участок гистологического препарата, который следует изучить при большом увеличении (объектив х40).большом увеличении 6.С помощью револьверного устройства ставят объектив с более сильным увеличением (х40). Установку резкости проводят с помощью микровинта.револьверного устройствамикровинта 7.Для изучения очень мелких гистологических структур используют иммерсионный объектив (х90).иммерсионный объектив На покровное стекло препарата наносят каплю иммерсионного масла. Осторожно опускают тубус до соприкосновения линзы объектива к маслу. Установку резкости проводят с помощью микровинта.микровинта После окончания работы иммерсионное масло удаляют с объектива и покровного стекла марлей. оглавлениеназад далее

Техника микроскопирования (примеры) оглавлениеназад Почка. Окраска: гематоксилин-эозин. Увеличение: х 56 (малое увеличение). Почка. Окраска: гематоксилин-эозин. Увеличение: х 280 (большое увеличение). Почка. Окраска: гематоксилин-эозин. Увеличение: х 630 (иммерсионное увеличение). далее

Темнопольная микроскопия назад Основана на использовании специального конденсора, освещающего препарат «косыми» лучами, не попадающими в объектив. При наличии объекта в поле зрения свет отражается от него и направляется в объектив. Метод часто используется для изучения живых неокрашенных клеток. оглавлениедалее

Поляризационная микроскопия назад Позволяет обнаружить двойное лучепреломление – анизотропию. На объект исследования направляется поляризованный пучок света, т.е. лучи света направлены строго в одной плоскости. Это обеспечивает особый фильтр – поляризатор. Такой свет направляется на объект исследования. Второй фильтр – анализатор расположен между объективом и окуляром и позволяет регистрировать угол отклонения плоскости поляризации света. Микроскопия позволяет регистрировать пространственное расположение молекул в объективе или кристаллические структуры. оглавление Кристаллы оксалатов. Поляризационная микроскопия. Увеличение х100 далее

Фазово-контрастная микроскопия назад Метод служит для получения контрастных изображений прозрачных и бесцветных объектов, в частности, позволяет изучать живые неокрашенные препараты. Даже при очень малых различиях в показателях преломления разных элементов препарата световая волна, проходящая через них, претерпевает разные изменения по фазе (приобретает фазовый рельеф). Эти фазовые изменения, не воспринимаемые глазом, преобразуются с помощью специального оптического устройства (кольцевой диафрагмы в конденсоре и фазовой пластинки в объективе) в изменения амплитуды световой волны, т. е. в изменения яркости («амплитудный рельеф»), которые уже различимы глазом. Иными словами, в получаемом видимом изображении распределение яркостей (амплитуд) воспроизводит фазовый рельеф. Получаемое таким образом изображение называется фазово- контрастным. оглавление Семенники крысы. Неокрашенный препарат. Фазовый контраст Семенники крысы. Окраска: гематоксилин-эозин Световая микроскопия Pseudotrichonympha grassi. Неокрашенный препарат. Фазовый контраст далее

Использует принцип свечения объекта исследования при освещении его ультрафиолетовыми лучами. Источником света служат специальные лампы. Существует аутофлюоресценция – собственная или первичная флюоресцен-ция. Например, свечение эластических волокон в стенке артерий. Вторичная флюоресценция возникает после обработки препаратов специальными красителями – флюорохромами (акридин оранжевый, родамин, флюоресцин и др.). Например: после обработки акридиновым оранжевым в клетке очень четко обнаруживается ядерная ДНК (ярко-зеленое свечение) и РНК (ярко-красное свечение). После фиксации тканей в парах формальдегида (метод Фалька) обнаруживается ярко-зеленое свечение серотонина, катехоламинов (адреналин, норадреналин).акридиновым оранжевымметод Фалька Если флюоресцентные красители связать со специфическими антителами – можно будет выявить их антигены. Этот метод получил название иммуноцитохимического. иммуноцитохимического Флюоресцентная (люминесцентная) микроскопия назадоглавлениедалее

Флюоресцентная (люминесцентная) микроскопия (примеры) Цитоскелет эукариот (эндотелиальные клетки быка). Имунноцитохимический метод окрашивания. Актиновые микрофиламенты окрашены в красный, микротрубочки в зеленый, ядра клеток в голубой цвет. назад.... Нуклеиновые кислоты в эпителии маточных желез. Окраска акридиновым оранжевым. Ядерная ДНК окрашена в зеленый цвет, РНК – в красный. Симпатические нервные сплетения. Метод Фалька оглавлениедалее

Электронная микроскопия назад Электронный микроскоп прибор, позволяющий получать изображение объектов с максимальным увеличением до 10 6 раз. Это стало возможно благодаря использованию вместо светового потока пучка электронов, длина волны которого во много раз короче длины волны фотонов видимого света. Электронный микроскоп состоит из электронной пушки (устройства для получения пучка электронов) и системы электромагнитных линз, размещенных в колонне микроскопа в условиях вакуума. Разрешающая способность электронного микроскопа в 1000÷10000 раз превосходит разрешение светового микроскопа и для лучших современных приборов может составлять менее 0,1 нм (м). Существуют две основные разновидности электронной микроскопии: трансмиссионная (просвечивающая) и сканирующая (растровая). трансмиссионнаясканирующая оглавлениедалее

Трансмиссионная (просвечивающая) электронная микроскопия примеры Принцип работы трансмиссионного электронного микроскопа заключается в том, что электроны, проходя через объект, расположенный вблизи объективной линзы, взаимодействуют с его атомами и отклоняются от первоначального направления падения пучка (рассеиваются). Далее они попадают в систему магнитных линз, которые формируют на флуоресцентном экране (и на фотопленке) изображение внутренней структуры объекта. При этом удается достичь разрешения порядка 0,1 нм, что соответствует увеличениям до 1,510 6 раз. Разрешение и информативность ТЭМ-изображений во многом определяются характеристиками объекта и способом его подготовки. Для получения контрастного изображения применяют ультратонкие срезы (не более 0,01 мкм), обработанные соединениями тяжелых металлов (импрегнация солями свинца, урана, осмия и др.), избирательно взаимодействующими с компонентами микроструктуры (химическое контрастирование). При этом чем большей рассеивающей способностью обладает участок исследуемого объекта (участки повышенной плотности, увеличенной толщины и пр.), тем более темным будет его изображение.изображение оглавление назад

Сканирующая (растровая) электронная микроскопия Принцип работы сканирующего электронного микроскопа (СЭМ) заключается в сканировании поверхности образца сфокусированным электронным пучком и анализе отраженных от нее частиц и рентгеновского излучения, возникающего в результате взаимодействия электронов с веществом. В СЭМ пучок электронов (электронный зонда) фокусируется электромагнитными линзами конденсора и объектива. Специальное устройство – дефлектор отклоняет электронный пучок (первичные электроны), который скользит по поверхности (растр). Вторичные электроны (отраженные от поверхности) воспринимаются детектором и фокусируются на экране СЭМ, создавая ее трехмерное изображение.трехмерное изображение Современный СЭМ позволяет работать в широком диапазоне увеличений приблизительно от х10 (что эквивалентно увеличению сильной ручной линзы) до х, что приблизительно в 500 раз превышает предел увеличения лучших оптических микроскопов. Поверхность сканирования обязательно напыляется металлом: платина, золото, палладий и др. оглавление назад примеры

Электронная микроскопия (примеры) трансмиссионнаясканирующая Тучная клетка назад Эритроциты в артериоле Эритроцит, тромбоцит, лейкоцит оглавление далее

Рекомендуемая литература назад 1.Гистология, цитология и эмбриология: Учебник. / Под ред. Ю.А.Афанасьева, С.Л.Кузнецова, Н.А.Юриной. – М.: Медицина, – 768 с. 2.Гистология, эмбриология, цитология: Учебник. / Под ред. Э.Г.Улумбекова, Ю.А.Челышева. – М.: «ГЭОТАР-Медиа», – 408 с. 3.Жункейра Л.К., Карнейро Ж. Гистология: Атлас: Уч.пос.; пер. с англ., под ред. В.Л. Быкова. – М.: «ГЭОТАР-Медиа», – 576 с. 4.Хэм А., Кормак Д. Гистология: в 5 томах; пер. с англ. – М.: Мир, оглавление

Предмет гистология. Методы гистологических исследований. Клеточная теория.
ВВЕДЕНИЕ В ГИСТОЛОГИЮ. СТРОЕНИЕ КЛЕТКИ.
Лекция 1
Гистология – это наука о строении, развитии и жизнедеятельности тканей материи. Ткани изучают в живом и неживом состоянии. Изучение гистологических объектов, их тончайшей структуры проводят при помощи микроскопов, которые увеличивают невидимые простым глазом детали строения в несколько сотен тысяч раз.
Курс гистологии условно разделен на следующие разделы:
1. Цитология - наука о клетке.
2. Эмбриология - наука о развитии, от зарождения до полного формирования организма.
3. Общая гистология - наука об общих закономерностях, присущих тканям.
4. Частная гистология – наука о строении, развитии органов и систем.
Главной задачей гистологии как предмета является получение знаний о микроскопическом и ультрамикроскопическом строении клеток, тканей органов и систем здорового организма, в неразрывной связи с их развитием и выполняемыми функциями.
Основными методами гистологических исследований являются микроскопирование и специальные (немикроскопические) методы (гистохимия, цитофотометрия, авторадиография и др.).
Объектами исследования могут быть живые или мертвые (фиксированные) клетки и ткани.
Для изучения клеток и тканей под микроскопом изготавливают гистологические препараты.
Основными методами исследования гистологических объектов являются световая и электронная микроскопия, которые широко используются в клинической и экспериментальной практике.
Светооптические микроскопы. Основная оптическая часть микроскопа состоит из объектива и окуляра. Объектив является наиболее ответственной оптической системой, дающей увеличенное изображение предмета. Окуляр - оптическая система, которая служит в качестве лупы при визуальном наблюдении увеличенного изображения предмета, даваемого объективом. Окуляр обычно увеличивает изображение в 5-25 раз.
Так же важнейшими характеристиками микроскопа являются разрешающая способность и увеличение. Разрешающая способность - минимальное расстояние между двумя точками объекта, которые видны раздельно. Увеличение микроскопа- величина, показывающая, во сколько раз линейные размеры изображения, формируемого оптической системой микроскопа, больше линейных размеров объекта. Увеличение микроскопа зависит от увеличений объектива и окуляра и численно равно произведению этих увеличений. Современные оптические микроскопы имеют предел полезного увеличения до 1500 раз.
Электронная микроскопия. Электронные микроскопы обладают высокой разрешающей способностью. Другими словами, в электронном микроскопе теоретически возможно повышение разрешающей способности и соответственно увеличение изображения в 150000 раз больше по сравнению со световым микроскопом. Наиболее часто в морфологических исследованиях используются просвечивающие электронные микроскопы, позволяющие получить плоскостное изображение изучаемого объекта. В последние годы активно применяются растровые (сканирующие) электронные микроскопы, способные создавать трехмерные изображение, т. е. получать пространственное изображение структур.
Методы количественного исследования микроструктур в гистологических и цитологических препаратах. Количественная оценка микроструктур является необходимым условием получения объективных данных об их состоянии в норме, при экспериментальных воздействиях и в патологии. Основными количественными показателями микроструктур являются морфометрические (число структур и их геометрические параметры) и денситометрические, отражающие концентрацию (оптическую плотность) химических веществ в микроструктурах. Для выявления этих параметров применяют морфометрические и спектрофотометрические методы, а также автоматизированные системы обработки изображений.
Изучение организма на тканевом и клеточном уровнях требует приготовления гистологических препаратов и их рассмотрения под микроскопом. Цель приготовления гистологического препарата заключается в том, чтобы путем обработки привести исследуемый материал в удобное для изучения под микроскопом состояние, сделать его прозрачным и контрастным.
Часто изучение материала в свежем виде является наиболее целесообразным (например, наблюдение за работой ресничек мерцательного эпителия). Для приготовления препарата берется чистое предметное стекло. На его середину помещается капля воды или физиологического раствора, в которую погружают кусочки ткани, подлежащей рассмотрению, и под контролем микроскопа расправляют их препаровальными иглами.
Чтобы сделать препарат контрастнее и получить возможность хорошо различать отдельные его детали, объект подвергают окрашиванию. При этом пользуются тем, что разные структуры тканей и клеток по-разному реагируют на тот или иной краситель.
Изготовление постоянных препаратов требует довольно большой затраты труден времени, такие препараты можно использовать в течение многих лет. Препараты готовят из небольших целых объектов (тотальные препараты) или срезов; При всех условиях объект или срез должен быть тонким и прозрачным, иначе невозможно его изучение под микроскопом.
Изготовление препарата состоит из нескольких этапов.
Основными Объектами исследования являются гистологические препараты, а главным методом исследования - микроскопирование.
Гистологический препарат должен быть достаточно прозрачным (тонким) и контрастным. Он изготавливается как из живых, так и из мёртвых (фиксированных) структур. Препарат может представлять собой взвесь клеток, мазок, отпечаток, плёнку, тотальный препарат и тонкий срез.
Процесс изготовления гистологических препаратов для микроскопических исследований включает в себя следующие основные этапы: 1) взятие материала и его фиксация; 2) уплотнение материала; 3) приготовление срезов; 4)окрашивание, или контрастирование срезов; 5) заключение срезов.
Для окрашивания применяются специальные гистологические красители с различным значением рН: кислые, нейтральные и основные. Структуры, окрашивающиеся ими, соответственно, называются оксифильными, нейтрофильными (гетерофильными) и базофильными.
Какими же методами пользуется гистологическая наука? Они довольно многочисленны и разнообразны:
Микроскопирование.
Световая микроскопия. Современные микроскопы обладают высокоразрешающей способностью. Разрешающая способность определяется наименьшим расстоянием (d) между двумя рядом расположенными точками, которые можно видеть раздельно. Это расстояние зависит от длины световой волны (λ) и выражается формулой: d = 1/2 λ.
Минимальная длина волны видимой части спектра 0,4 мкм. Следовательно, разрешающая способность светового микроскопа составляет 0,2 мкм, а общее увеличение достигает 2500 раз.
Ультрафиолетовая микроскопия . Длина волны ультрафиолетового света – 0,2 мкм, следовательно, разрешающая способность ультрафиолетового микроскопа 0,1 мкм, но так как ультрафиолетовое излучение является невидимым, то для наблюдения исследуемого объекта необходим люминесцентный экран.
Флюоресцентная (люминесцентная) микроскопия. Коротковолновое (невидимое) излучение, поглощаясь рядом веществ, возбуждает их электроны, которые излучают свет с большей длиной волны, становясь видимой частью спектра. Таким образом, добиваются повышения разрешающей способности микроскопа.
Фазовоконтрастная микроскопия позволяет излучать неокрашенные объекты.
Поляризационная микроскопия применяется для изучения архитектоники гистологических структур, например, коллагенового волокна.
Электронная микроскопия даёт возможности изучать объекты, увеличенные в десятки тысяч раз.
Микрофотосъёмка и микрокиносъёмка . Эти методы позволяют изучать фиксированные объекты на фотографиях и живые микроскопические объекты в движении.
Методы качественных и количественных исследований.
Гисто – и цитохимия , в том числе количественная, позволяет проводить качественный анализ исследуемых объектов на тканевом, клеточном и субклеточном уровнях.
Цитоспектрофотометрия Даёт возможность изучать количественное содержание тех или иных биологических веществ в клетках и тканях на основе поглощения света определённой длины волны связанным ими красителем.
Дифференциальное центрифугирование позволяет разделять содержимое клеток, отличающихся между собой своей массой.
Радиография Основана на включении радиоактивной метки (например, радиоактивного йода, Н³-тимидина и др.) в обменный процесс.
Морфометрия позволяет производить измерение площадей и объёмов клеток, их ядер и органелл с помощью окуляр - и объект-микрометров и специальных сеток.
Применение ЭВМ для автоматической обработки цифрового материала.
Метод культуры тканей представляет собой поддержание жизнеспособности и деления клеток и тканей вне организма. Для этого используют специальные контейнеры с питательной средой, в которых создаются все необходимые условия для жизнедеятельности клеток. С помощью этого метода можно изучать дифференцировку и функциональное становление клеток, закономерности их злокачественного перерождения и развития опухолевого процесса, межклеточное взаимодействие, поражение клеток и тканей вирусами и микроорганизмами, влияние лекарственных препаратов на обменные процессы в клетках и тканях и т. д.
Прижизненное (витальное) окрашивание используется для изучения явлений фагоцитоза и активности макрофагов, фильтрационной способности почечных канальцев и др.
Метод трансплантации тканей . Этот метод применяют с целью изучения поведения клеток и их морфофункционального состояния при их пересадке в другой организм. К примеру, этот метод используется для поддержания жизни животных, подверженных облучению смертельной дозой.
Микроманипуляции. Данный метод получил применение в молекулярной биологии, генной инженерии, а также при клонировании, когда с помощью микроманипулятора удаляют ядро из яйцеклетки с гаплоидным набором хромосом и пересаживают в неё ядро соматической клетки с диплоидным набором хромосом.
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФГБОУ ВПО «САХАЛИНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
ЕСТЕСТВЕННОНАУЧНЫЙ ФАКУЛЬТЕТ
КАФЕДРА ЭКОЛОГИИ И ПРИРОДОПОЛЬЗОВАНИЯ
КОНТРОЛЬНАЯ РАБОТА
по дисциплине «Гистология и эмбриология рыб
на тему «Методы исследования в гистологии»
Студент 2 курса
Терехов Степан Сергеевич
Научный руководитель,
ст. преподаватель кафедры экологии и природопользования
А.В. Бойко
Южно-Сахалинск
Введение
Гистология - наука об особенностях организации, функций и развития тканей и тканевом строении органов. Основным объектом изучения гистологии служат ткани, которые представляют собой филогенетически сложившиеся, топографически и функционально связанные клеточные системы и их производные, из которых образованы органы. Для того что бы понять как это всё устроено и работает, человечеству понадобилось пройти через многое, начиная с линз Антони Ванн Левенгука, когда было положено начало изучению всего живого, не видимое ранее. К современным же методам изучения, относят основной, микроскопирование.
Цель работы: Рассмотреть методы исследования в гистологии, научиться работать с гистологическими препаратами и понимать сам процесс изучения тканей различными способами микроскопирования.
1. Методы исследования в гистологии, основа
В зависимости от объекта изучения гистологию подразделяют на нормальную (изучает ткани здорового организма) и патологическую (патогистологию), которая исследует изменения тканей при заболеваниях и повреждениях (ее обычно рассматривают как раздел патологической анатомии). В силу специфики объекта и методов исследования выделяют нейрогистологию, а также учение о крови и кроветворении, ставшее теоретической основой гематологии. Кроме того, различают ряд направлений в гистологии - описательную гистологию (описание тканей), сравнительную гистологию (сравнение тканей различных видов животных), эволюционную гистологию (закономерности развития тканей в филогенезе), экологическую гистологию (изучает ткани в связи с воздействием условий обитания), экспериментальную гистологию. В гистологии используют многочисленные методы исследования - микроскопию, экспериментальный, тканевых культур (Афанасьев 1989).
Основной предмет изучения гистологии - комплексы клеток, составляющие ткани, в их взаимодействии друг с другом и с промежуточными средами. Являясь частью морфологии, гистология тесно связана с цитологией, анатомией, эмбриологией. Методологическую основу гистологии составляют клеточная теория и эволюционное учение. Гистологию принято разделять на общую (изучает общие закономерности развития, строения и функции тканей) и частную (изучает микроскопическое строение отдельных органов и систем организма). Специальными разделами гистологии являются гистохимия (химия тканей) и гистофизиология (механизмы деятельности тканей) (Юшканцева 2006).
2. Методы исследования
Методы исследования в гистологии включают приготовление гистологических препаратов с последующим их изучением с помощью светового или электронного микроскопа. Гистологические препараты представляют собой мазки, отпечатки органов, тонкие срезы кусочков органов, возможно, окрашенные специальным красителем, помещенные на предметное стекло микроскопа, заключенные в консервирующую среду и покрытые покровным стеклом.
В современной гистологии, цитологии и эмбриологии применяются разнообразные методы исследования, позволяющие всесторонне изучать процессы развития, строения и функции клеток, тканей и органов.
Главными этапами гистологического анализа являются выбор объекта исследования, подготовка его для изучения в микроскопе, применение методов микроскопирования, а также качественный и количественный анализ изображений.
Объектами исследования служат живые и мертвые (фиксированные) клетки и ткани, и их изображения, полученные в световых и электронных микроскопах.
Основным объектом исследования являются гистологические препараты, приготовленные из фиксированных структур. Препарат может представлять собой мазок(например, мазок крови, костного мозга, слюны, спинномозговой жидкости и др.),отпечаток (например, селезенки, тимуса, печени), пленку из ткани (например, соединительной или брюшины, плевры, мягкой мозговой оболочки), тонкий срез. Наиболее часто для изучения используется срез ткани или органа. Гистологические препараты могут изучаться без специальной обработки. Например, приготовленный мазок крови, отпечаток, пленка или срез органа могут сразу рассматриваться под микроскопом. Но вследствие того, что структуры имеют слабый контраст, они плохо выявляются в обычном световом микроскопе и требуется использование специальных микроскопов (фазово-контрастные и др.). Поэтому чаще применяют специально обработанные препараты: фиксированные, заключенные в твердую среду и окрашенные (Юрина 1999).
Процесс изготовления гистологического препарата для световой и электронной микроскопии включает следующие основные этапы:
взятие материала и его фиксация,
уплотнение материала,
приготовление срезов,
окрашивание или контрастирование срезов.
Для световой микроскопии необходим еще один этап - заключение срезов в бальзам или другие прозрачные среды.
Фиксация обеспечивает предотвращение процессов разложения, что способствует сохранению целостности структур. Это достигается тем, что взятый из органа маленький образец либо погружают в фиксатор (спирт, формалин, растворы солей тяжелых металлов, осмиевая кислота, специальные фиксирующие смеси), либо подвергают термической обработке. Под действием фиксатора в тканях и органах происходят сложные физико-химические изменения. Наиболее существенным из них является процесс необратимой коагуляции белков, вследствие которого жизнедеятельность прекращается, а структуры становятся мертвыми, фиксированными. Фиксация приводит к уплотнению и уменьшению объема кусочков, а также к улучшению последующей окраски клеток и тканей.
Уплотнение материала, необходимое для приготовления срезов, производится путем пропитывания предварительно обезвоженного материала парафином, целлоидином, органическими смолами. Более быстрое уплотнение достигается применением метода замораживания кусочков, например, в жидкой углекислоте.
Приготовление срезов происходит на специальных приборах - микротомах (для световой микроскопии) и ультрамикротомах (для электронной микроскопии).
Окрашивание срезов (в световой микроскопии) или напыление их солями металлов (в электронной микроскопии) применяют для увеличения контрастности изображения отдельных структур при рассматривании их в микроскопе. Методы окраски гистологических структур очень разнообразны и выбираются в зависимости от задач исследования.
Гистологические красители (по химической природе) подразделяют на кислые, основные и нейтральные. В качестве примера можно привести наиболее употребительный краситель гематоксилин, который окрашивает ядра клеток в фиолетовый цвет, и кислый краситель - эозин, окрашивающий цитоплазму в розово-желтый цвет. Избирательное сродство структур к определенным красителям обусловлено их химическим составом и физическими свойствами. Структуры, хорошо окрашивающиеся кислыми красителями, называются оксифильными, а окрашивающиеся основными - базофильными. Например, цитоплазма клеток чаще всего окрашивается оксифильно, а ядра клеток - окрашиваются базофильно.
Структуры, воспринимающие как кислые, так и основные красители, являются нейтрофильными (гетерофильными). Окрашенные препараты обычно обезвоживают в спиртах возрастающей крепости и просветляют в ксилоле, бензоле, толуоле или некоторых маслах. Для длительного сохранения обезвоженный гистологический срез заключают между предметным и покровным стеклами в канадский бальзам или другие вещества. Готовый гистологический препарат может быть использован для изучения под микроскопом в течение многих лет (Юрина, Радостина 1999).
В электронной микроскопии срезы, полученные на ультрамикротоме, помещают на специальные сетки, контрастируют солями урана, свинца и других металлов, после чего просматривают в микроскопе и фотографируют. Полученные микрофотографии служат объектом изучения наряду с гистологическими препаратами.
3. Методы микроскопирования гистологических препаратов
Микроскопия может быть световая (с использованием светового микроскопа) иэлектронная (с использованием электронного микроскопа). Световая микроскопия может осуществляться в проходящем свете, когда свет проходит через тонкий прозрачный гистологический препарат, или же в отраженном свете, когда исследуют, например, толстый или непрозрачный объект. Аналогичным образом, электронная микроскопия может быть трансмиссионной, когда пучок электронов проходит сквозь изучаемый ультратонкий срез, или же растровой, или сканирующей, когда пучок электронов отражается от поверхности исследуемого объекта. В первом случае электронный микроскоп называется трансмиссионным (ТЭМ), а во втором - сканирующим (СЭМ).
1 Световая микроскопия
Микроскопирование - основной метод изучения препаратов - используется в биологии уже более 300 лет. Современные микроскопы представляют собой разнообразные сложные оптические системы, обладающие высокой разрешающей способностью и позволяющие изучать очень тонкие детали строения клеток и тканей. Размер самой маленькой структуры, которую можно видеть в микроскопе, определяется наименьшим разрешаемым расстоянием (d0). В основном оно зависит от длины световой волны ?, и эта зависимость приближенно выражается формулой d0 = ? / 2. Таким образом, чем меньше длина световой волны, тем меньше разрешаемое расстояние и тем меньшие по размерам структуры можно видеть в препарате (т.е. выше «разрешение» микроскопа). Понятие «увеличение микроскопа» относится к его оптической системе и выражается в произведении увеличений объектива и окуляра. Однако «разрешение» микроскопа зависит от характеристик объектива и не зависит от окуляра.
Для изучения гистологических препаратов чаще применяют обычные световые микроскопы различных марок, когда в качестве источника освещения используют естественный или искусственный свет. Минимальная длина волны видимой части спектра света соответствует примерно 0,4 мкм (фиолетовый спектр). Следовательно, для обычного светового микроскопа разрешаемое расстояние равно приблизительно 0,2 мкм, а общее увеличение (произведение увеличения объектива на увеличение окуляра) достигает 2000 раз.
Единицы измерения, используемые в гистологии: Для измерения структур в световой микроскопии используются в основном микрометры: 1 мкм составляет 0,001 мм; в электронной микроскопии используются нанометры: 1 нм составляет 0,001 мкм (Юшканцева 2006)
2 Ультрафиолетовая микроскопия
Это разновидность световой микроскопии. В ультрафиолетовом микроскопе используют более короткие ультрафиолетовые лучи с длиной волны около 0,2 мкм. Разрешаемое расстояние здесь составляет приблизительно 0,1 мкм. Полученное в ультрафиолетовых лучах невидимое глазом изображение преобразуется в видимое с помощью регистрации на фотопластинке или путем применения специальных устройств (т.к. люминесцентный экран, или электронно-оптический преобразователь) (Юрина 1999)
3 Флюоресцентная (люминесцентная) микроскопия
Явления флюоресценции заключаются в том, что атомы и молекулы ряда веществ, поглощая коротковолновые лучи, переходят в возбужденное состояние. Обратный переход из возбужденного состояния в нормальное происходит с испусканием света, но с другой, большей длиной волны. В флюоресцентном микроскопе в качестве источников света для возбуждения флюоресценции применяют ртутные или ксеноновые лампы сверхвысокого давления, обладающие высокой яркостью в области спектра 0,25-0,4 мкм (ближние ультрафиолетовые лучи) и 0,4-0,5 мкм (сине-фиолетовые лучи). Длина световой волны вызванной флюоресценции всегда больше длины волны возбуждающего света, поэтому их разделяют с помощью светофильтров и изучают изображение объекта только в свете флюоресценции. Различают собственную, или первичную, и наведенную, или вторичную, флюоресценцию. Любая клетка живого организма обладает собственной флюоресценцией, однако она часто бывает чрезвычайно слабой. Вторичная флюоресценция возникает при обработке препаратов специальными красителями - флюорохромами <#"justify">Артишевский, А. А. Гистология с техникой гистологических
исследований (1999)
Антипчук, Ю. П. Гистология с основами эмбриологии (1983)
Афанасьев Ю.И., Юрина Н.А. - Гистология, цитология и эмбриология (1989) "Медицина"
Афанасьев Ю.И., Юрина Н.А. - Гистология, цитология и эмбриология (2002) "Медицина"
Быков В.Л. Частная гистология человека "Сотис" 1999
Заварзин А.А., Строева О.Г. - Сравнительная гистология. Учебник "СпБ" 2000
Кузнецов С.Л., Мушкамбаров Н.Н. - Атлас по гистологии, цитологии и эмбриологии "МИА" 2002
Рябов, К. П. Гистология с основами эмбриологии: учебное пособие (1990)
Улумбеков Э.Г., Челышев Ю.А. - Гистология. Учебник для ВУЗов (1997) "Геотар" 1997
Челышев Ю.А. - Графические тесты по гистологии, цитологии, эмбриологии "КГМУ" 2000
Юрина Н.А., Радостина А.И. - Практикум по гистологии, цитологии и эмбриологии "УДН" 1999
Юшканцева С.И., Быков В.Л. - Гистология, цитология и эмбриология. Краткий атлас "П-2" 2006
Репетиторство
Нужна помощь по изучению какой-либы темы?
Наши специалисты проконсультируют или окажут репетиторские услуги по интересующей вас тематике.
Отправь заявку
с указанием темы прямо сейчас, чтобы узнать о возможности получения консультации.
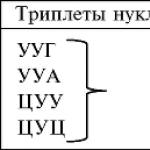
Гистологические срезы затем окрашивают специально подобранными красителями, большинство из которых избирательно окрашивает структурные компоненты клеток и тканей. Все красители можно разделить на три группы:
После окрашивания гистологические срезы быстро обезвоживают в спиртах, просветляют в ксилоле или толуоле, переносят на предметное стекло, заливают тонким слоем канадского бальзами или полистирола и накрывают покровным стеклом. Бальзам, полистирол и стекло имеют одинаковый показатель преломления света, и лучи света минимально рассеиваются, проходя через препарат.