Константа равновесия
Для химической обратимой реакции, представленной в общем виде:
аА+ЬВ ^dD+eE,
установлено, что, независимо от того, каковы были начальные концентрации реагентов, присутствовали или нет продукты реакции, в состоянии равновесия сохраняется постоянным отношение: где [А] /; , [В] ; „ [D] ; „ [Е] ; , - равновесные молярные концентрации реагентов и продуктов реакции; a, b, d, е - стехиометрические коэффициенты в уравнении реакции; К с - константа химического равновесия.
Константа химического равновесия зависит от температуры, природы веществ, но не зависит от концентрации реагирующих веществ, т.к. она показывает при каких соотношениях произведений концентраций реагирующих веществ в системе наступает химическое равновесие.
Данная формула является выражением закона действующих масс для равновесия, установленного Гульдбергом и Вааге (1867).
Для равновесий между газообразными веществами удобнее пользоваться не молярными концентрациями, а парциальными давлениями газообразных веществ; в этом случае константа равновесия обозначается К р («ка-эр»):
D Е Р р а pb А В
Константа равновесия, выраженная через концентрации, и константа равновесия, выраженная через парциальные давления веществ, связаны соотношением:
К р = K c RTAn,
где Ап - разность коэффициентов при формулах газообразных веществ в правой и левой частях уравнения.
При Дп=0 константы равновесия К р и К с равны.
Таким образом, константа химического равновесия представляет собой дробь, в числителе которой стоит произведение равновесных концентраций (если реакция протекает в растворе) или равновесных парциальных давлений (для реакций в газовой фазе) продуктов реакций, возведенных в степени, показатели которых равны стехиометрическим коэффициентам. А в знаменателе - произведение концентраций (или парциальных давлений) исходных веществ, возведенных в соответствующие степени.
Если протекает гетерогенная реакция
2С(Х) + 0 2 ^ 2СО,
то константа равновесия имеет вид
т.е. в выражение константы равновесия гетерогенной реакции входят равновесные концентрации веществ, находящихся только в жидкой или газообразной фазах.
Константа равновесия определяет полноту протекания реакции к моменту достижения равновесного состояния: чем больше значение константы равновесия, тем в большей степени в равновесной реакционной смеси преобладают продукты реакции, тем больше выход продуктов реакции.
Смещение химического равновесия. Принцип Лe Шателье
При изменении условий, в которых находится система (температура, давление, концентрация), химическое равновесие нарушается. Через некоторое время в системе устанавливается новое химическое равновесие, соответствующее новым условиям. Переход от одного равновесного состояния в другое называется сдвигом или смещением равновесия.
Направление смещения химического равновесия в результате изменения внешних условий определяется принципом Jle Шателье: если на систему, находящуюся в истинном равновесии, воздействовать извне, изменяя какое- либо из условий, определяющих положение равновесия, то в системе усилится то из направлений процесса, которое ослабляет эффект этого воздействия, и положение равновесия сместится в том же направлении.
Кратко этот принцип формулируется так: если находящаяся в равновесии система подвергается внешнему воздействию, то равновесие смещается в таком направлении, которое способствует ослаблению этого воздействия.
Химическим равновесием называется такое состояние обратимой химической реакции
aA + b B = c C + d D,
при котором с течением времени не происходит изменения концентраций реагирующих веществ в реакционной смеси. Состояние химического равновесия характеризуется константой химического равновесия :
где C i – концентрации компонентов в равновесной идеальной смеси.
Константа равновесия может быть выражена также через равновесные мольные доли X i компонентов:
Для реакций, протекающих в газовой фазе, константу равновесия удобно выражать через равновесные парциальные давления P i компонентов:
Для идеальных газов P i = C i RT и P i = X i P , где P – общее давление, поэтому K P , K C и K X связаны следующим соотношением:
K P = K C (RT) c+d–a–b = K X P c+d–a–b . (9.4)
Константа равновесия связана с r G o химической реакции:
![]() (9.5)
(9.5)
![]() (9.6)
(9.6)
Изменение r G или r F в химической реакции при заданных (не обязательно равновесных) парциальных давлениях P i или концентрациях C i компонентов можно рассчитать по уравнению изотермы химической реакции (изотермы Вант-Гоффа ):
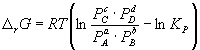 . (9.7)
. (9.7)
 . (9.8)
. (9.8)
Согласно принципу Ле Шателье , если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие сместится так, чтобы уменьшить эффект внешнего воздействия. Так, повышение давления сдвигает равновесие в сторону уменьшения количества молекул газа. Добавление в равновесную смесь какого-либо компонента реакции сдвигает равновесие в сторону уменьшения количества этого компонента. Повышение (или понижение) температуры сдвигает равновесие в сторону реакции, протекающей с поглощением (выделением) теплоты.
Количественно зависимость константы равновесия от температуры описывается уравнением изобары химической реакции (изобары Вант-Гоффа )
![]() (9.9)
(9.9)
и изохоры химической реакции (изохоры Вант-Гоффа )
![]() . (9.10)
. (9.10)
Интегрирование уравнения (9.9) в предположении, что r H реакции не зависит от температуры (что справедливо в узких интервалах температур), дает:
![]() (9.11)
(9.11)
![]() (9.12)
(9.12)
где C – константа интегрирования. Таким образом, зависимость ln K P от 1/Т должна быть линейной, а наклон прямой равен – r H /R .
Интегрирование в пределах K 1 , K 2 , и T 1, T 2 дает:
 (9.13)
(9.13)
 (9.14)
(9.14)
По этому уравнению, зная константы равновесия при двух разных температурах, можно рассчитать r H реакции. Соответственно, зная r H реакции и константу равновесия при одной температуре, можно рассчитать константу равновесия при другой температуре.
ПРИМЕРЫ
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K. f G o для CO(г) и CH 3 OH(г) при 500 К равны –155.41 кДж. моль –1 и –134.20 кДж. моль –1 соответственно.
Решение. G o реакции:
r G o = f G o (CH 3 OH) – f G o (CO) = –134.20 – (–155.41) = 21.21 кДж. моль –1 .
![]() = 6.09 10 –3 .
= 6.09 10 –3 .
Пример 9-2. Константа равновесия реакции
равна K P = 1.64 10 –4 при 400 o C. Какое общее давление необходимо приложить к эквимолярной смеси N 2 и H 2 , чтобы 10% N 2 превратилось в NH 3 ? Газы считать идеальными.
Решение. Пусть прореагировало моль N 2 . Тогда
| N 2 (г) | + | 3H 2 (г) | = | 2NH 3 (г) | |
| Исходное количество | 1 | 1 | |||
| Равновесное количество | 1– | 1–3 | 2 (Всего: 2–2) | ||
| Равновесная мольная доля: |
Следовательно, K
X =  и K P = K X . P
–2
=
и K P = K X . P
–2
=  .
.
Подставляя = 0.1 в полученную формулу, имеем
1.64 10 –4 =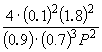 , откуда P
= 51.2 атм.
, откуда P
= 51.2 атм.
Пример 9-3. Константа равновесия реакции
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K равна K P = 6.09 10 –3 . Реакционная смесь, состоящая из 1 моль CO, 2 моль H 2 и 1 моль инертного газа (N 2) нагрета до 500 K и общего давления 100 атм. Рассчитать состав равновесной смеси.
Решение. Пусть прореагировало моль CO. Тогда
| CO(г) | + | 2H 2 (г) | = | CH 3 OH(г) | |
| Исходное количество: | 1 | 2 | 0 | ||
| Равновесное количество: | 1– | 2–2 | |||
| Всего в равновесной смеси: | 3–2 моль компонентов + 1 моль N 2 = 4–2 моль | ||||
| Равновесная мольная доля | |||||
Следовательно, K
X =  и K P = K X . P –2
=
и K P = K X . P –2
= ![]() .
.
Таким образом, 6.09 10 –3
= ![]() .
.
Решая это уравнение, получаем = 0.732. Соответственно, мольные доли веществ в равновесной смеси равны: = 0.288, = 0.106, = 0.212 и = 0.394.
Пример 9-4. Для реакции
N 2 (г) + 3H 2 (г) = 2NH 3 (г)
при 298 К K P = 6.0 10 5 , а f H o (NH 3) = –46.1 кДж. моль –1 . Оценить значение константы равновесия при 500 К.
Решение. Стандартная мольная энтальпия реакции равна
r H o = 2 f H o (NH 3) = –92.2 кДж. моль –1 .
Согласно уравнению (9.14),  =
=
Ln (6.0 10 5) + ![]() = –1.73, откуда K
2 =
0.18.
= –1.73, откуда K
2 =
0.18.
Отметим, что константа равновесия экзотермической реакции уменьшается с ростом температуры, что соответствует принципу Ле Шателье.
ЗАДАЧИ
- При 1273 К и общем давлении 30 атм в равновесной смеси
- При 2000 o C и общем давлении 1 атм 2% воды диссоциировано на водород и кислород. Рассчитать константу равновесия реакции
- Константа равновесия реакции
- Константа равновесия реакции
- Сосуд объемом 3 л, содержащий 1.79 10 –2 моль I 2 , нагрели до 973 K. Давление в сосуде при равновесии оказалось равно 0.49 атм. Считая газы идеальными, рассчитать константу равновесия при 973 K для реакции
- Для реакции
- Для реакции
- Сосуд объемом 1 л, содержащий 0.341 моль PCl 5 и 0.233 моль N 2 , нагрели до 250 o C. Общее давление в сосуде при равновесии оказалось равно 29.33 атм. Считая все газы идеальными, рассчитать константу равновесия при 250 o C для протекающей в сосуде реакции
- Константа равновесия реакции
- При 25 o C f G o (NH 3) = –16.5 кДж. моль –1 . Рассчитать r G реакции образования NH 3 при парциальных давлениях N 2 , H 2 и NH 3 , равных 3 атм, 1 атм и 4 атм соответственно. В какую сторону реакция будет идти самопроизвольно при этих условиях?
- Экзотермическая реакция
- Константа равновесия газофазной реакции изомеризации борнеола (C 10 H 17 OH) в изоборнеол равна 0.106 при 503 K. Смесь 7.5 г борнеола и 14.0 г изоборнеола поместили в сосуд объемом 5 л и выдерживали при 503 K до достижения равновесия. Рассчитать мольные доли и массы борнеола и изоборнеола в равновесной смеси.
- Равновесие в реакции
- Рассчитать общее давление, которое необходимо приложить к смеси 3 частей H 2 и 1 части N 2 , чтобы получить равновесную смесь, содержащую 10% NH 3 по объему при 400 o C. Константа равновесия для реакции
- При 250 o C и общем давлении 1 атм PCl 5 диссоциирован на 80% по реакции
- При 2000 o C для реакции
- Рассчитать стандартную энтальпию реакции, для
которой константа равновесия
а) увеличивается в 2 раза, б) уменьшается в 2 раза при изменении температуры от 298 К до 308 К. - Зависимость константы равновесия реакции 2C 3 H 6 (г) = C 2 H 4 (г) + C 4 H 8 (г) от температуры между 300 К и 600 К описывается уравнением
CO 2 (г) + C(тв) = 2CO(г)
содержится 17% (по объему) CO 2 . Сколько процентов CO 2 будет содержаться в газе при общем давлении 20 атм? При каком давлении в газе будет содержаться 25% CO 2 ?
H 2 O(г) = H 2 (г) + 1/2O 2 (г) при этих условиях.
CO(г) + H 2 O(г) = CO 2 (г) + H 2 (г)
при 500 o C равна K p = 5.5. Смесь, состоящая из 1 моль CO и 5 моль H 2 O, нагрели до этой температуры. Рассчитать мольную долю H 2 O в равновесной смеси.
N 2 O 4 (г) = 2NO 2 (г)
при 25 o C равна K p = 0.143. Рассчитать давление, которое установится в сосуде объемом 1 л, в который поместили 1 г N 2 O 4 при этой температуре.
I 2 (г) = 2I (г).
при 250 o C r G o = –2508 Дж. моль –1 . При каком общем давлении степень превращения PCl 5 в PCl 3 и Cl 2 при 250 o C составит 30%?
2HI(г) = H 2 (г) + I 2 (г)
константа равновесия K P = 1.83 10 –2 при 698.6 К. Сколько граммов HI образуется при нагревании до этой температуры 10 г I 2 и 0.2 г H 2 в трехлитровом сосуде? Чему равны парциальные давления H 2 , I 2 и HI?
PCl 5 (г) = PCl 3 (г) + Cl 2 (г)
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K равна K P = 6.09 10 –3 . Рассчитать общее давление, необходимое для получения метанола с 90% выходом, если CO и H 2 взяты в соотношении 1: 2.
CO(г) + 2H 2 (г) = CH 3 OH(г)
находится в равновесии при 500 K и 10 бар. Если газы идеальные, как повлияют на выход метанола следующие факторы: а) повышение T ; б) повышение P ; в) добавление инертного газа при V = const; г) добавление инертного газа при P = const; д) добавление H 2 при P = const?
2NOCl(г) = 2NO(г) + Cl 2 (г)
устанавливается при 227 o C и общем давлении 1.0 бар, когда парциальное давление NOCl равно 0.64 бар (изначально присутствовал только NOCl). Рассчитать r G o для реакции. При каком общем давлении парциальное давление Cl 2 будет равно 0.10 бар?
N 2 (г) + 3H 2 (г) = 2NH 3 (г)
при 400 o C равна K = 1.60 10 –4 .
PCl 5 (г) = PCl 3 (г) + Cl 2 (г).
Чему будет равна степень диссоциации PCl 5 , если в систему добавить N 2 , чтобы парциальное давление азота было равно 0.9 атм? Общее давление поддерживается равным 1 атм.
N 2 (г) + O 2 (г) = 2NO(г)
K p = 2.5 10 –3 . В равновесной смеси N 2 , O 2 , NO и инертного газа при общем давлении 1 бар содержится 80% (по объему) N 2 и 16% O 2 . Сколько процентов по объему составляет NO? Чему равно парциальное давление инертного газа?
ln K = –1.04 –1088 /T +1.51 10 5 /T 2 .
Вернемся к процессу производства аммиака, выражающемуся уравнением:
N 2 (г) + 3H 2 (г) → 2NH 3 (г)
Находясь в закрытом объеме, азот и водород соединяются и образуют аммиак. До каких пор будет протекать этот процесс? Логично предположить, что до тех пор, пока какой-либо из реагентов не закончится. Однако, в реальной жизни это не совсем так. Дело в том, что через некоторое время после того, как началась реакция, образовавшийся аммиак станет разлагаться на азот и водород, т.е., начнется обратная реакция:
2NH 3 (г) → N 2 (г) + 3H 2 (г)
Фактически в закрытом объеме будут протекать сразу две, прямо противоположные друг другу, реакции. Поэтому, данный процесс записывается таким уравнением:
N 2 (г) + 3H 2 (г) ↔ 2NH 3 (г)
Двойная стрелка указывает на то, что реакция идет в двух направлениях. Реакция соединения азота и водорода называется прямой реакцией . Реакция разложения аммиака - обратной реакцией .
В самом начале процесса скорость прямой реакции очень велика. Но с течением времени концентрации реагентов уменьшаются, а количество аммиака возрастает - как следствие скорость прямой реакции уменьшается, а скорость обратной - возрастает. Наступает время, когда скорости прямой и обратной реакций сравниваются - наступает химическое равновесие или динамическое равновесие. При равновесии протекает как прямая, так и обратная реакции, но их скорости одинаковы, поэтому изменений не заметно.
Константа равновесия
Разные реакции протекают по-разному. В одних реакциях до момента наступления равновесия образуется довольно большое количество продуктов реакции; в других - гораздо меньше. Т.о., можно сказать, что конкретное уравнение имеет свою константу равновесия. Зная константу равновесия реакции, можно определить относительное количество реагентов и продуктов реакции, при котором наступает химическое равновесие.
Пусть некоторая реакция описывается уравнением: aA + bB = cC + dD
- a, b, c, d - коэффициенты уравнения реакции;
- A, B, C, D - химические формулы веществ.
Константа равновесия:
[C] c [D] d K = ———————— [A] a [B] b
Квадратные скобки показывают, что в формуле участвуют молярные концентрации веществ.
О чем говорит константа равновесия?
Для синтеза аммиака при комнатной температуре К=3,5·10 8 . Это довольно большое число, свидетельствующее о том, что химическое равновесие наступит когда концентрация аммиака будет намного больше оставшихся исходных веществ.
При реальном производстве аммиака задача технолога состоит в том, чтобы получить как можно бОльший коэффициент равновесия, т.е., чтобы прямая реакция прошла до конца. Каким образом этого можно добиться?
Принцип Ле Шателье
Принцип Ле Шателье гласит:
Как это понять? Все очень просто. Нарушить равновесие можно тремя способами:
- изменив концентрацию вещества;
- изменив температуру;
- изменив давление.
Когда реакция синтеза аммиака находится в равновесии, то это можно изобразить так (реакция экзотермическая):
N 2 (г) + 3H 2 (г) → 2NH 3 (г) + Теплота
Меняем концентрацию
Введем дополнительное количество азота в сбалансированную систему. При этом баланс нарушится:

Прямая реакция начнет протекать быстрее, поскольку количество азота увеличилось и он вступает в реакцию в большем количестве. Через некоторое время снова наступит химическое равновесие, но при этом концентрация азота будет больше, чем концентрация водрода:

Но, осуществить "перекос" системы в левую часть можно и другим способом - "облегчив" правую часть, например, отводить аммиак из системы по мере его образования. Т.о., снова будет преобладать прямая реакция образования аммиака.
Меняем температуру
Правую сторону наших "весов" можно изменять путем изменения температуры. Для того, чтобы левая часть "перевесила", необходимо "облегчить" правую часть - уменьшить температуру:

Меняем давление
Нарушить равновесие в системе при помощи давления можно только в реакциях с газами. Увеличить давление можно двумя способами:
- уменьшением объема системы;
- введением инертного газа.
При увеличении давления количество столкновений молекул возрастает. При этом повышается концентрация газов в системе и изменяются скорости прямой и обратной реакций - равновесие нарушается. Чтобы восстановить равновесие система "пытается" уменьшить давление.
Во время синтеза аммиака из 4-х молекул азота и водорода образуется две молекулы аммиака. В итоге количество молекул газов уменьшается - давление падает. Как следствие, чтобы придти к равновесию после увеличения давления, скорость прямой реакции возрастает.
Подведем итог. Согласно принципу Ле Шателье увеличить производство аммиака можно:
- увеличивая концентрацию реагентов;
- уменьшая концентрацию продуктов реакции;
- уменьшая температуру реакции;
- увеличивая давление при котором происходит реакция.
Все химические реакции можно разделить на обратимые и необратимые. К обратимым относятся такие реакции, которые при определенной температуре с заметной скоростью протекают в двух противоположных направлениях - прямом и обратном. Обратимые реакции протекают не до конца, ни одно из реагирующих веществ не расходуется полностью. Примером может служить реакция
В определенной области температуры данная реакция обратима. Знак « » является знаком обратимости.
Необратимые реакции - это такие реакции, которые протекают только в одном направлении до конца, т.е. до полного расходования одного из реагирующих веществ. Примером необратимой реакции может служить реакция разложения хлората калия:
Образование хлората калия из хлорида калия и кислорода в обычных условиях невозможно.
Состояние химического равновесия. Константа химического равновесия
Запишем уравнение некоторой обратимой реакции в общем виде:
К моменту начала реакции концентрации исходных веществ А и В были максимальными. В ходе реакции они расходуются, и их концентрация уменьшается. При этом в соответствии с законом действующих масс скорость прямой реакции
будет уменьшаться. (Здесь и далее стрелка наверху обозначает направление процесса.) В начальный момент концентрации продуктов реакции D и Е были равны нулю. В ходе реакции они увеличиваются, скорость обратной реакции возрастает от нуля согласно уравнению:
На рис. 4.5 представлено изменение скоростей прямой и обратной
реакции во времени. По истечении времени т эти скорости сравня- -»

Рис. 4.5. Изменение скорости прямой (1) и обратной (2) реакции во времени: - в отсутствие катализатора: ..........- при наличии катализатора
Такое состояние называется химическим равновесием. Химическое равновесие является наиболее устойчивым, предельным состоянием самопроизвольного протекания процессов. Оно может продолжаться сколь угодно долго, если не изменять внешних условий. В изолированных системах в состоянии равновесия энтропия системы достигает максимума и остается постоянной, т.е. dS = 0. В изобарно-изотермических условиях движущая сила процесса, энергия Гиббса, при равновесии принимает минимальное значение и далее не изменяется, т.е. dG = 0.
Концентрации участников реакции в состоянии равновесия называются равновесными. Как правило, их обозначают формулами соответствующих веществ, заключенных в квадратные скобки, например равновесная концентрация аммиака обозначается в отличие от исходной, неравновесной концентрации C^ NH ^.
Поскольку скорости прямого и обратного процессов в состоянии равновесия равны, приравняем и правые части уравнений (4.44) и
- -^ i -
- (4.45), заменив обозначение концентраций: А: [А]"”[В]" = ?[D] /; }



